
图1 药品原始创新链
药品创新既是推动健康中国战略、增进人民福祉的支撑,又是以人民为中心发展思想的具体体现,更是保障国家公共卫生安全和彰显大国话语权的重要倚靠。创新产出质量和数量衡量创新能力,及时性、安全性和可及性衡量健康质量。当前,中国药品创新产出结构不甚合理,一方面,通过鼓励仿创结合(增量创新与仿制药)增加仿制药数量基本解决了药品可及性和局部安全性问题。另一方面,疗效更好、副作用更低的原研药在中国的价格高且种类少,在及时性和全面安全性方面仍严重制约着国民用药质量。为此,《“十三五”卫生与健康科技创新专项规划》将通过原始创新优化药品供给结构作为提高全民健康质量的重要途径。创新模式既是创新主体开展原始创新所采用的构思和路径,也是创新主体合理配置创新资源、顺利实施原始创新计划的前提和保障。通过对原始创新模式演化的梳理,分析不同创新模式研发路径,讨论其核心要素,进而为中国本土创新主体依据自身现状选择合理的创新方式提供参照,对于实质性提升中国制药行业的原始创新能力具有重要意义。
原始创新(Radical Innovations)是一种探索式创新,狭义的原始创新由创新主体根据基础研究理论对现有技术进行根本性变革[1]。广义上的原始创新还包括将技术性研究成果经过试验、生产、销售等一系列步骤,覆盖从基础研究到商品化的全过程[2]。Chesbrough[3]根据原始创新的主体分工不同,将原始创新模式分为独立型和合作型。Li&Kozhikode[4]进一步指出,独立型和合作型模式从管理学角度分别对应创新主体对创新的垂直一体化管理和横向一体化管理。事实上,合作型模式由多个独立型创新活动构成,根据各独立创新主体的贡献,可以分为企业主导和非企业(高校及科研院所)主导,形式上有联合开发、技术并购等模式[5]。
关于原始创新模式选择,Gemünden等[6]从企业生命周期角度出发,认为企业不同阶段所持有的资源和内在需求不同,所选择的创新模式也会不同。Suri&Banerji[7]认为,企业应从分析市场潜在需求与合理配置自身资源两方面设计原始创新路径,进而选择恰当的模式。Vertinsky[8]认为,绝大多数研发主体从意愿上倾向于独立型原始创新模式,但是通常受制于自身内部资源和能力,需要寻求与其他主体合作,资源互补是企业进行有效合作的前提。原长弘等[9]基于251家中国内地企业的实证研究证实,中国企业合作创新的低效率是由于相互之间资源重复性过高。此外,近年来,一些行业的研发风险不断升高,很多创新主体会选择合作型原始创新模式[10]。
更加具体的是,基础研究累积、经济投入、创新主体自我发展需求等内部因素,以及金融偏好、竞争环境、政策导向、市场集中度等外部因素都会影响创新主体模式选择[11]。其中,基础研究累积对创新主体选择原始创新模式的影响最显著[12],是原始创新各种模式的路径起点,并决定了原始创新距离[13]。Klevorick[14]以食品行业为例,将基础研究量化为专利数量,证实专利越集中,原始创新模式越独立,研发周期就越短。
相对于集成创新和引进创新等利用式创新,原始创新具有更高的风险,在其内部,不同的原始创新模式所承担的风险也不尽相同。对于创新主体而言,独立型模式所承担的风险远高于合作型模式,联合开发模式所承担的风险高于技术并购模式。当前,原始创新模式由以独立型为主逐步过渡到风险共担的合作型为主[15]。
Bessen&Meurer[16]通过对制药、机械和电子领域研究发现,药品原始创新最依赖专利保护,在所有行业中药品创新成果申请率最高,专利对药品仿制成本提升是其它行业的4倍以上。因此,制药企业非常关注创新模式在原始创新过程中的技术保密性。Hu等[17]通过不同时间节点的对比研究发现,药品原始创新对基础研究累积需求越来越高,创新主体自身技术资源却未能成比例增长,因而需要创新模式能够更加有效地整合和配置资源。Ciliberti等[18]认为,随着药品原始创新投入持续增加和周期不断延长,风险也不断提升,创新主体在设计创新模式时需要考虑有效的风险规避。Katholieke[19]通过对美国、日本和欧洲33个大型制药企业实证研究发现,独立型创新模式能够为创新者带来最高的回报,合作型模式可以使原始创新更有效率,药品创新主体出于保密和盈利能力的考虑,倾向于选择独立创新模式,出于资源优化和风险分摊的角度考虑,应选择合作型创新模式[20]。可见,药品原始创新社会分工将会越来越细化[21]。
通过对现有文献分析发现,目前,针对国内外原始创新模式研究的理论成果丰富,集中于原始创新模式影响因素、选择以及路径等方面,但是对于制药行业原始创新模式研究仍比较鲜见且缺乏深度,且全部集中在发达国家制药行业,关于中国制药行业的原始创新模式,尚未进行系统化研究。但已有学者指出,中国内资制药企业长期处于创新连低端[22],基础研究薄弱、研发经费投入不足、缺少有效的原始创新周期性战略规划[23],国家制药行业整体创新水平与制药强国差距显著[24]。因此,鉴于国情差异,现有原始创新模式很难被中国本土创新主体完全复制,本土创新主体亟待通过恰当的创新模式提升原始创新能力。本文通过梳理制药行业原始创新模式演化历程,分析不同时期原始创新模式的特点及影响因素,归纳出制药行业原始创新模式的内在规律,可作为中国制药行业开展药品原始创新的参照。
药品原始创新主体包括制药企业和非企业(高校及科研院所),提供原始创新所需要的基础研究、研发经费等资源,其中,只有企业能够承担商品化职能,从而完成广义上原始创新整体链条。因此,一直以来,制药企业是原始创新模式的主导者。完整的原始创新过程应遵循以下路径:①针对病理病灶,依靠先前技术积累进行药物分子模拟,得到新分子实体(NME);②通过病理试验筛选和优化新分子实体,得到活性化合物(NCE);③进行动物试验验证毒性和有效性;④剂型研究;⑤临床试验;⑥生产销售。以临床试验为分界点,临床试验以前的创新研究属于狭义上的原始创新,而临床后的研究包括临床试验和生产,属于广义上的原始创新。在整体创新链条中,第一步最为关键,是原始创新的核心,严格意义上讲,只有从第一步开始的创新才能真正称为原始创新(见图1)。综上所述,药品原始创新范式为:第一步,进行活性分子筛选与合成;第二步,验证活性分子的安全性和有效性,并固定于适合的剂型载体;第三步,进行临床试验和生产。任何药品的原始创新都要经过上述3个阶段,不同的创新模式主要体现为各个阶段参与创新活动的主体性质、数量、分工不同。
20 世纪60年代以前,制药企业掌握着原始创新的绝对主导权,通常以垂直一体化模式进行独立创新,提供原始创新所需的技术、经费和研究人员等资源。几乎每个制药企业都拥有非常完整的药品生产产业链和价值链,包括实施基础研究、临床试验、药物申报、药物生产以及营销等,从药物开发上游环节一直到市场开发下游环节(见图2),持有绝大多数代表原始创新成果的产品和方法专利,并且持有的原始创新成果所涉及的疾病领域分散。20 世纪50年代,原创创新平均投入在230万美元左右,到60年代末上升至2 180万美元,时间周期平均为51.5个月,成功率达到10‰[25]。制药企业采用独立研发模式主要得益于先前技术和资本的原始积累、相对较低的研发成本和风险,以及宽松的法律监管环境。
然而,1959年“反应停”事件后,各国大幅提升了对于化学药品,特别是原始创新药品安全性和有效性的要求,并逐渐由集中在上市前的安全监管扩大到上市前与上市后同步监管,直接增加了原始创新研发成本和成功风险,越来越多的中小型制药企业开始退出原始创新链核心环节。自20世纪60年代初期开始,只有大型制药企业才能采用垂直一体化原始创新模式,但是对独立进行原始创新的投入正逐年减少[26]。

图1 药品原始创新链

图2 垂直一体化合作模式
2.3.1 委托合作型药品原始创新模式
以垂直一体化为主的独立型原始创新模式,一方面使大型制药公司增加技术原始积累和最大限度地获得经济收益,从而为原始创新可持续进行提供保障;另一方面,也会使大型制药企业陷入“创造性陷阱”,逐渐失去创新动力,在一定程度上阻碍制药行业创新技术发展。为了激发企业原始创新的竞争性,自上世纪70年代开始,美国等发达国家开始鼓励和资助非企业积极参与原始创新,但由于政府资助项目所产生的专利权由政府持有,而且复杂的审批程序使研究成果难以得到及时、有效配置[27],从而降低了非企业科研人员的积极性。同时,由于绝大多数专利由制药企业掌握,高校及科研院所独立开展原始创新受到限制。而且,委托合作模式通常由制药企业主导,对于高校及科研院所技术性依赖较低,非企业主要专注于动物实验和剂型研发等非核心环节(见图3),以专利为代表的原始创新成果以及后续技术开发权仍由制药企业掌握。鉴于原始创新成本持续上升,上世纪70年代平均为5 400万美元,研发周期延长至69.3个月,但成功率降低至5.2‰[28],制药企业希望通过委托合作模式降低部分研发成本。
2.3.2 共享合作型药品原始创新模式
20世纪80年代,发达国家对于科技成果转化愈加重视,以美国《拜杜法案》为代表的一系列法律政策给予了非企业大力进行原始创新的动力。非企业积极介入原始创新核心环节,为了解决技术积累、研发经费以及后续成果利用等问题,高校及科研院所邀请大型制药企业对非企业科研人员进行技术指导,通过奖教金和研发基金模式获取制药企业经费资助,并通过无偿提供科研人员和部分研发经费作为对价,最终创新成果通常由双方共同享有(见图4)。在政策支持下,共享合作创新模式在一定程度上有效配置了原始创新的技术资源、经济资源和人力资源,但是由于技术积累和大部分研发费用等核心资源仍由制药企业提供,所以创新成果享有权仍为制药企业所占据,非企业只能将创新成果用于科学研究或是从事与制药企业无竞争关系的活动,“创造性陷阱”未能得到有效改变。原始创新成本上升至1.25亿美元,时间周期约为80.7个月,成功率下降至2.4‰,共享模式虽然不能降低研发成本,但却能进一步分散创新风险。

图3 委托合作模式

图4 共享合作模式
2.3.3 供需合作型药品原始创新模式
尽管共享合作创新模式未能有效解决创新研发成果的后续有效利用问题,但却为非企业提供了宝贵的技术积累和研发经验。而且,经过近20年的合作,制药企业所掌握的绝大多数专利技术已经到期,随着政府资助力度不断加大和非企业本身投入逐年增加,以及与企业相比所具备的人力成本优势,非企业具备独立进行原始创新的基础。自21世纪开始,新化学实体分子探索变得十分困难,平均每个原始创新药物投入超过13亿美元,研发周期约为115.3个月,但对应的成功率却降至0.7‰[29]。日益增长的原始创新风险已经为制药行业所重视,制药企业对于原始创新的态度更加谨慎,倾向于通过直接交易获得具有一定成熟度的前期成果,从而使得非企业逐渐成为原始创新核心环节的独立开发者,鉴于缺乏临床试验经费和产品生产资质,非企业仍需要寻求企业合作,才能完成广义上的原始创新。但是在供需合作创新模式下,作为创新成果输出者,非企业掌握了主导权,甚至能分享企业最终产品的经济收益(见图5)。
供需合作模式可被视作一种特殊的独立型模式,在技术创新环节和产业化环节,分别为非企业与企业独立承担投入和风险。虽然它解决了非企业原始创新成果归属和后续使用问题,提高了非企业在原始创新中的地位,但其弊端在于:非企业缺少市场竞争压力,创新成果供给与制药企业需求存在差距,一定程度上降低了创新资源配置效率。此外,过度依赖非企业供给会导致制药企业逐步失去原始创新所需要的技术积累,并且使其在创新成果转让议价中处于不利地位,以溢价获得所需创新成果不利于其长期发展战略实施,更为关键的是将丧失核心竞争力。因此,制药企业必须寻求能够制衡的创新模式。
2.3.4 横向一体化合作型药品原始创新模式
与共享合作模式及供需合作模式的合作主体为非企业和制药企业不同,横向一体化模式是制药企业通过购买或是控股等方式获得其它制药企业的控制权(见图6),进而获得专利等原始创新关键资源[30],主要形式有两种:①大型企业之间的并购,主要在于整合创新资源,降低创新成本。例如,辉瑞公司并购惠氏公司,两家企业得以共享心血管和神经系统方面的专利,从而消除了原始创新壁垒;②小型创新公司在某个领域掌握了关键技术或专利,大型企业通过资产置换、收购小型创新公司,从而巩固自身在该领域的技术优势地位。例如,默克公司收购了Idenix公司,强化了其在肝炎领域的技术积累。当前,大型制药企业收入有70%来自非本公司内部研发产品[31]。
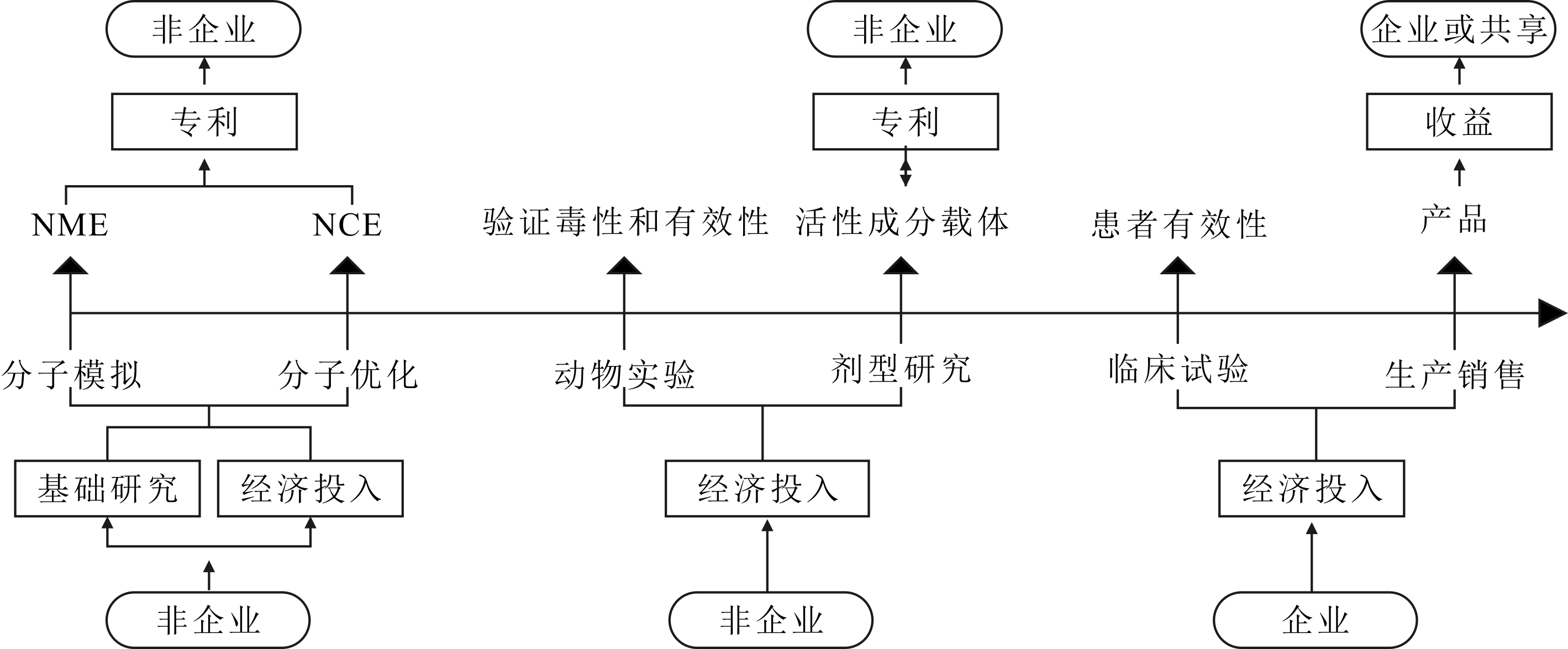
图5 供需合作模式
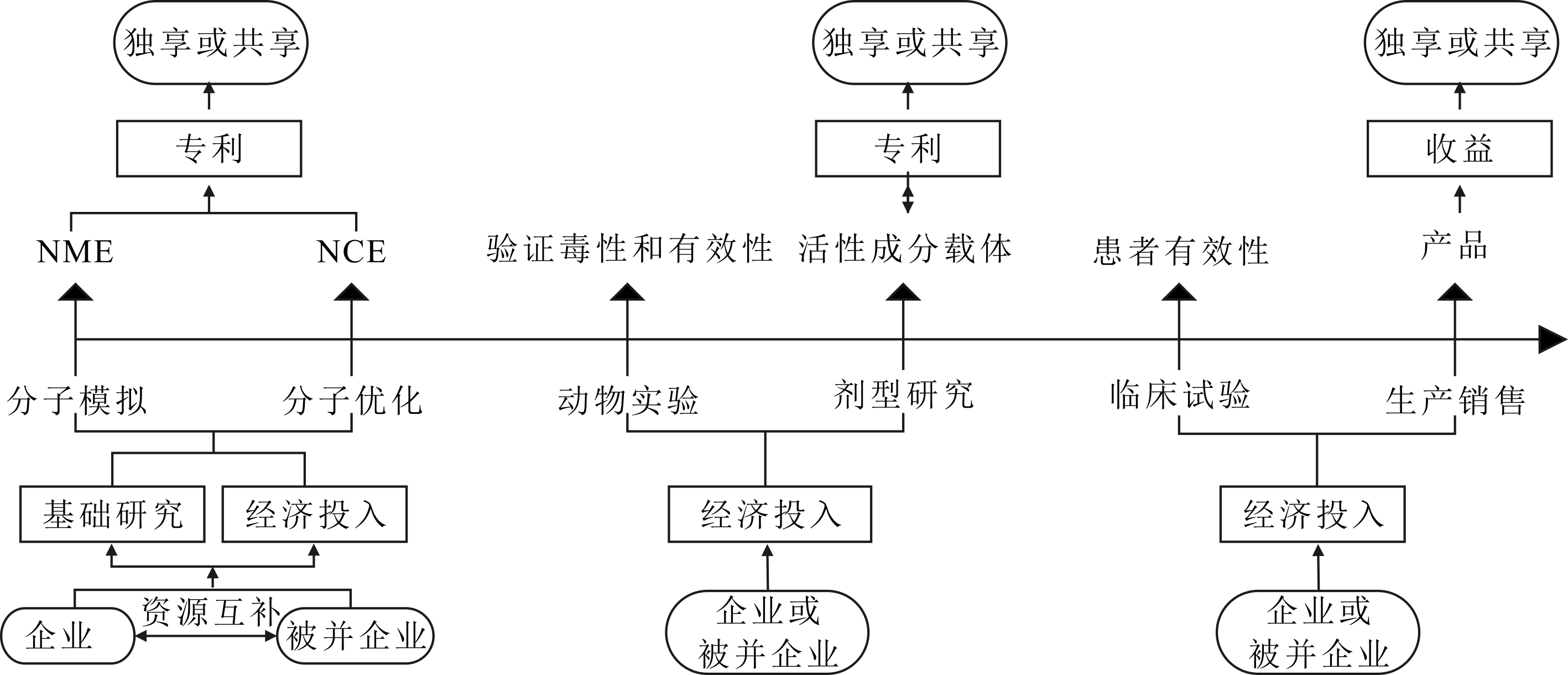
图6 横向一体化合作模式
由于原始创新难度和风险不断提升,各大制药企业将创新范围集中到其技术积累的优势领域。横向一体化合作模式与垂直一体化独立模式的不同之处在于:被并购企业仍然保持独立法人身份,双方共享资源,属于合作关系,特点在于通过并购其它企业获得创新战略实施所需的互补资源,提升双方现有原始创新资源使用效率,增强制药企业原始创新能力,使其能够重新掌握原始创新的核心环节,在一定程度上减少对非企业的依赖。
不论是独立模式还是合作模式,创新主体面临的原始创新风险越来越高,并且这种风险不可规避,同时失败后损失的时间成本和经济成本与风险成正比。因此,如何进一步分散风险成为原始创新主体设计创新模式时重点考虑的要素。近年来,通过引入第三方投资机构分散原始创新风险成为制药企业创新模式,药品原始创新链核心环节的风险收益特征契合风险投资需求,其风险收益率与计算机、金融等风险投资机构青睐的行业相当[32]。
风险投资模式按照资本进入的节点分为两种:①风险资本在原始创新的核心环节进入,在核心环节研发结束后退出;②风险资本在临床试验阶段进入,并在完成申报生产之后退出(见图7)。与传统风险投资不同,制药行业的风投对象通常为成熟制药企业,双方更趋于平等合作关系,风险资本的进入会分摊制药行业风险。严格意义上讲,风险投资模式也属于一种合作创新模式,但是投资机构本质上是通过原始创新期权获得收益的,不持有创新成果所有权和未来收益权,因此不会损害制药企业技术核心竞争力,而且进入21世纪以来,制药行业风险投资回报率逐步上升[33]。
不同的原始创新模式具有不同特点(见表1),创新主体在不同创新模式中扮演的角色不同,所承担的职责和所享受的权益也有所差别,影响创新主体选择原始创新模式的因素有包括资源投入与创新成果归属在内的显性因素和包括创新风险承担能力在内的隐性因素。自上世纪50年代以来,原始创新成本不断上升,但是创新成功率却不断下降,对应的创新风险也不断提升(见图8)。参与创新主体结构由单一化变为多元化,权益由独享变为共享,由垂直一体化这一个体收益最高和承担风险最高的创新模式,逐步向合作型这类收益和风险共担的创新模式演化,预示着未来创新主体在创新模式选择过程中,将由收益导向转为风险导向。

图7 风险投资合作模式
表1 药品原始创新模式特点

模式创新主体主导合作资源投入技术经费创新成果归属技术(专利)收益垂直一体化企业—企业企业企业企业委托合作企业非企业企业企业企业企业共享合作企业非企业企业共担共享企业或共享供需合作非企业企业非企业共担非企业企业或共享横向一体化企业被并企业互补共担独享或共享独享或共享风投模式企业投资机构企业投资机构企业企业

图8 药品原始创新投入、周期与成功率变化趋势
目前,中国境内专注于药品原始创新核心环节的主体主要有两类:一类是以高校及科研院所为主的非企业。在中国非企业不具备药品生产资质,因此,其原始创新环节最多延伸至临床试验阶段。鉴于当前中国内资制药企业以增量创新为主,几乎不会实质性参与原始创新的核心环节,中国本土创新主体的原始创新以供需合作创新模式为主。另一类是跨国制药企业在中国设置的研发中心。例如,诺和诺德(Novo Nordisk)在北京成立研发中心,赛诺菲(Sanofi)、强生(Johnson & Johnson)分别在上海成立创新中心。跨国制药企业在华的原始创新表面上以独立型模式为主,但Motohashi[34]指出,跨国制药企业在华研发中心所承担的是与临床阶段对接部分,真正的核心技术研发仍然在国外完成,原因在于中国临床试验成本和标准较低,并且将与临床对接的研发中心设置在中国有利于后期生产和在华销售,因而融入了更多的网络合作工作要素。
3.2.1 参与原始创新主体相对单一
迄今为止,中国没有上市一个自主研发的NME或NCE药物,换言之,中国没有本土创新主体实现成功的原始创新。通过检索中国知识产权局(SIPO)专利数据库发现,SIPO在2007—2016年授权的药品专利中,核心创新环节对应的成果:8个NME专利,8个NCE专利,14个光学异构体专利,NME专利和NCE专利全部归属于国外权利人,8个NME专利和4个NCE专利研发自国外非企业,4个NCE专利研发自国外企业。近年来,光学异构体作为基础研究的技术储备得到发展中国家研究者的重视,其中,8个研发自国内非企业,3个研发自国内企业,2个研发自国外非企业,1个研发自国外企业(见图9),说明在原始创新核心环节,国外企业和非企业相对均衡,中国的创新主体主要集中于非企业,并且国外创新主体的创新成果数量和质量也远高于中国本土创新主体。
3.2.2 原始创新模式相对单调
在中国境内完成药品原始创新,国内非企业以供需合作型为主,而跨国制药企业以独立型为主,究其原因主要在于:①跨国制药企业并未在华从事原始创新的核心环节研发,仅从事一般环节的原始创新,而一般环节通常并不需要合作;②中国法律规定,非企业单位不具备药品产业化资格,非企业不可能通过独立型创新模式完成原始创新。因此,尽管事实上国内非企业独立完成全部技术开发环节,但是在产业化环节仍要与企业通过供需合作型创新模式以真正地完成原始创新;③本土制药企业缺少技术上的原始积累,直接参与原始创新的能力有限,更不可能为非企业提供技术支持,难以与非企业建立委托合作关系;④本土制药企业难以承受原始创新风险,特别是原始创新所需要的时间成本,无法长期对非企业提供原始创新所需要的经济支持,很难形成共享式合作;⑤药品原始创新属于封闭型创新,跨国制药企业作为技术垄断者不会与中国创新主体进行核心技术合作研发,而且由于药品涉及国民健康和国家安全,国内创新主体也难以通过购买方式获得相应的原始创新技术资源,从而难以进行国内外企业横向一体化合作;⑥由于药品原始创新的周期长、投入大,并且中国本土原始创新能力相对薄弱,难以吸引风险资本进行合作。
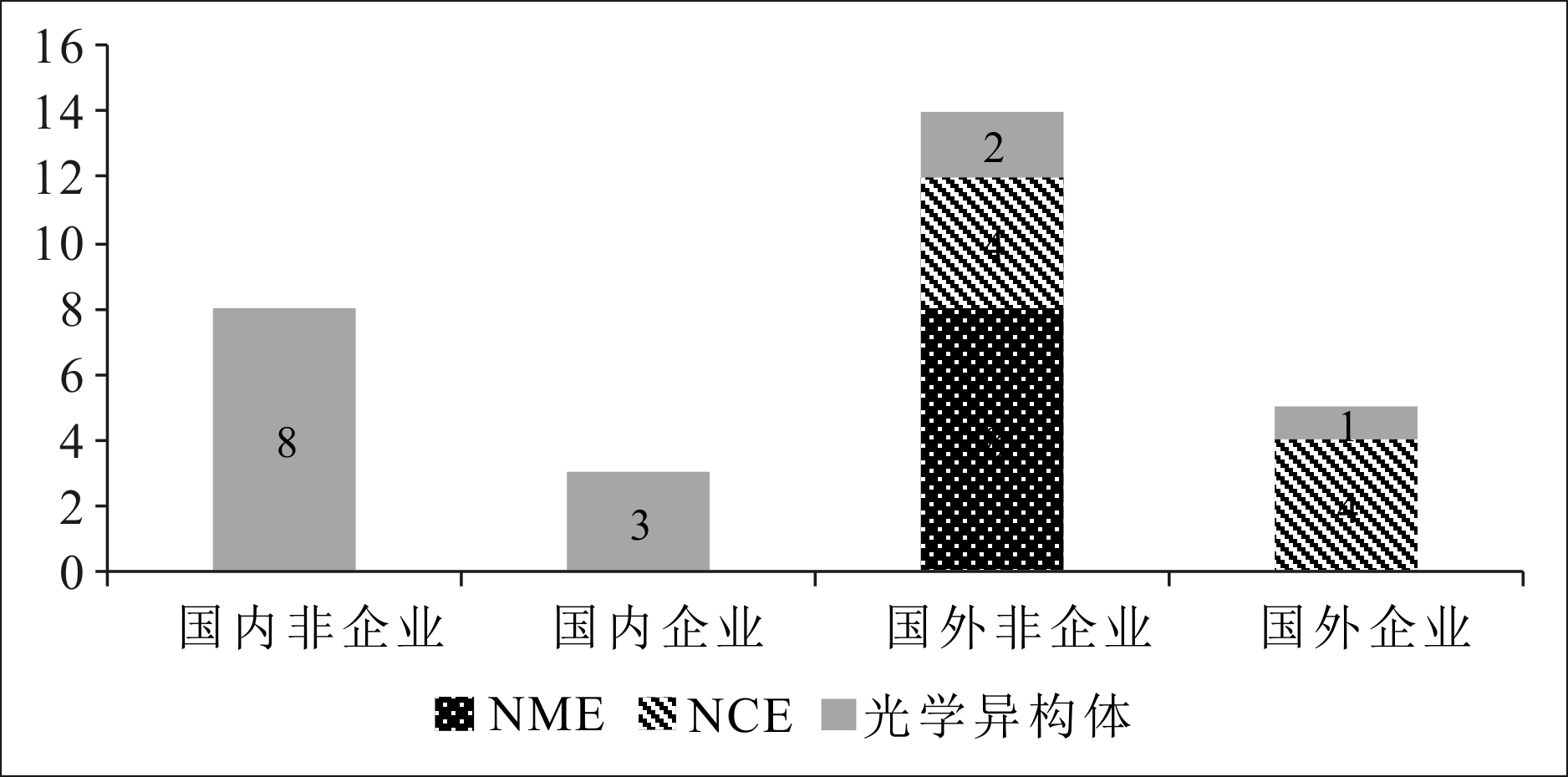
图9 原始创新核心成果分布
3.2.3 缺少实现创新模式的多元化资源
(1)原始技术积累薄弱。发达国家和发展中国家的原始创新鸿沟体现为基础研究方面的差距[35]。中国制药行业长期处于创新链下游,创新主体特别是制药企业出于节约成本和降低风险的考虑,热衷于对原始创新药进行增量创新,使得本土创新者缺少自主原始技术积累。SIPO在2007—2016年授权的药品专利共有411个,其中,116个化合物专利,归属于国内权利人的专利65个,归属于国外权利人的专利51个;14个用途专利,全部归属于国外专利权人;84个剂型专利,归属于国内权利人的专利49个,归属于国外权利人的专利35个;197个方法专利,归属于国内权利人的专利118个,归属于国外权利人的专利79个。可见,尽管归属于中国籍专利权人的专利数量多于外籍专利权人,但中国籍专利权人所持有的专利通常为化学中间体、剂型、方法的增量创新专利,基础研究专利数量远少于外籍专利权人。同时,跨国制药企业对原始创新的核心环节严密控制,一方面通过专利进行保护,另一方面限制通过商业交易向中国创新主体输出技术。
(2)同质竞争现象严重。与发达国家相比,中国制药行业本土原始创新的一个显著特点就是创新主体以非企业为主,国内非企业进行的原始创新以自由探索为主,通常缺乏系统性和导向性。而国内制药企业主要从事增量创新,企业规模小且重复性研发严重,引发同质产品竞争,使同行之间很难达成有效合作。此外,同质竞争摊薄了本土制药企业利润,导致其对创新的反哺能力不足。例如,国际制药巨头研发投入占销售收入的比重一般为20%左右,而国内投入最高不超过10%,加上企业规模小,按绝对额估计,中国制药业的研发投入仅为美、日等主要发达国家的0.5%左右[36]。
(3)缺少有效激励政策。近年来,为实现《“十三五”卫生与健康科技创新专项规划》目标,中国大力推进药品创新规范体制改革,参照美国药品创新体系调整了药品注册分类,制定了药品专利链接制度,旨在从创新制度上与世界发达国家接轨。然而,由于现阶段中国本土制药企业的技术基础和经济积累不足以支撑原始创新,因此,对国内创新主体而言,创新规范体制得以有效实施的前提条件可能并不成熟,本土创新主体更需要的是具有可操作性的政策激励措施,从而增加技术原始积累和超额收益,进而驱动原始创新。
随着技术不断更新、创新难度和成本上升,以及市场竞争加剧,创新主体需要根据自身资源和内在需求不断寻求最优创新模式。从最初的制药企业独立创新模式,到以成本导向的企业与非企业委托合作模式和共享合作模式,再到以主导权本位的供需合作模式和横向一体化模式,以及风险规避导向的风险投资模式,制药行业的原始创新模式发展虽然以资源控制或降低风险控制为导向,但其实现却是以原始技术积累为核心,以经济投入为支撑的。因此,中国制药行业,包括创新主体和政府应以增加原始积累和研发投入为目标,设计有效的创新模式和管理体制,以期有效驱动药品原始创新。
(1)创新主体间应开展多元化合作。在中国,作为非企业的高校及科研院具有先天技术研发优势,但是不具备将药品原始创新转为产品的资质和经济实力,因而决定了其只能与制药企业合作才能真正实现原始创新。因此,制药企业全面参与,特别是深度参与原始创新核心环节是中国原始创新能力提升的关键。当前,中国本土制药企业应根据自身掌握的资源,通过选择合理的合作模式逐步参与核心环节的原始创新。例如,仅具有一定基础研究累积的企业可以选择共享模式,而仅具有一定经济优势的企业可以选择横向一体化模式。制药企业通过选择合适的原始创新模式,获得原始创新所需要的技术连续性和时间,从而使中国制药行业的原始创新进入规范、有序的发展轨道,最终形成良性的原始创新生态圈。
(2)引导国内制药企业规模化和集中化发展。通过国外制药行业的原始创新模式演化研究发现,创新主体只有具备原始创新核心资源,才能掌握原始创新的主导权。在原始创新模式演化过程中,大型制药企业作为引领者,是推动药品原始创新模式发展的重要力量。因此,中国政府应该提升制药行业准入门槛,设置投入资本、规模、技术先进性等标准,有计划、有步骤地淘汰不符合标准的企业,通过减少同质化恶性竞争,有效配置创新资源,提升企业经济利润,培植出拥有技术积累和经济资本等原始创新资源的大型制药企业,最终实现产业升级。
(3)通过政策激励风险资本支持药品原始创新。进入21世纪后,金融和资本市场给制药行业的原始创新产业带来了巨大冲击,高风险的技术创新和巨大的投资需求决定了中国高科技产业在技术创新时需要选择合适的合作伙伴分担风险。参考国外药品原始创新模式,金融工具可以有效提升制药行业创新能力,由于中国当前药品原始创新仍处于低端水平,并且药品研发周期长,对于风险资本的吸引力有限,仅依靠市场调节难以对药品原始创新形成实质性支撑。因此,需要通过政策引导风险资本介入,具体来讲:一方面,引导国有投资机构对具有原始创新能力的创新主体予以支持;另一方面,通过政策红利吸引民间资本投资药品原始创新,红利可以包括税收优惠、投资补贴等。
总体上,药品原始创新模式分为独立型与合作型,独立模式以技术和资源相对集中为前提,合作模式则建立在资源互补的基础上。但无论是独立模式还是合作模式,均以技术累积和规模经济投入为基础,最终目的是在适当的风险下和时间周期内实现超额利润。药品原始创新模式演化表现为创新主体在各个环节的合作模式和分工变化,多元化分工和风险分散成为当前药品原始创新模式的主要特点,并且参与者范围也扩大到风险投资企业等非行业内主体。中国制药行业现状是技术基础薄弱、研发创新投入不足、行业内低水平竞争严重,中国本土创新主体已经意识到仅通过增量创新难以维持企业竞争优势,只有通过原始创新掌握关键核心技术,才能增强自身竞争力。因此,首先,中国制药行业应调整产业结构,从国家宏观政策到企业具体经营,加大原始创新扶持力度,特别要注重基础研究,以增加原始积累。其次,创新主体应进行合理分工合作,实现资源整合,发挥各类创新主体优势,减少资源浪费和无序竞争。最后,通过风险共担机制降低创新失败带来的损失,例如,通过行业内联合创新、吸引外部风险资本等。希望中国国内创新主体能够根据各自资源配置,依托切实可行的战略目标调整创新模式,最终实现理想的原始创新生态循环。
本文归纳了药品原始创新的二种基本模式及其基发展和变化,重点讨论了药品原始创新各个环节创新主体所承担的职能和风险,以及药品原始创新的关键影响因素。限于篇幅,本文讨论集中在理论层面,未进一步通过典型案例和规模样本数据进行验证。此外,在药品原始创新风险不断上升的趋势下,各个环节风险控制成为药品原始创新模式选择的关键性因素,如何进行风险量化是未来研究的热点问题。因此,一方面,学者们可以通过典型案例、规模样本分析对研究结果进行验证。另一方面,可以针对创新链中的重要环节风险,通过数理模型进行量化,从而为创新者提供决策依据。
[1] DEWAR R D,DUTTON J E.The adoption of radical and incremental innovations:an empirical analysis[J].Management Science,1986,32(11):1422-1433.
[2] SCHUMPETER J A.The theory of economic development[M].Oxford:Oxford University Press,1912.
[3] CHESBROUGH H W.Open innovation:the new imperative for creating and profiting from technology[M].Boston:Harvard Business Press,2006.
[4] CHESBROUGH H W.Open innovation:the new imperative for creating and profiting from technology[M].Boston:Harvard Business Press,2006.
[5] GENG D,SAGGI K.The nature of innovative activity and the protection of intellectual property in Asia[J].Asian Economic Policy Review,2015,10(1):71-91.
[6] GEMÜNDEN H G,SALOMO S,HÖLZLE K.Role models for radical innovations in times of open innovation[J].Creativity and Innovation Management,2007,16(4):408-421.
[7] SURI F K,BANERJI A.Super generics-first step of Indian pharmaceutical industry in the innovative space in US market[J].Journal of Health Management,2016,18(1):161-171.
[8] VERTINSKY L.Patents,partnerships,and the pre-competitive collaboration myth in pharmaceutical innovation[J].UC Davis Law Review,2015,48(3):101-173.
[9] 原长弘,章芬,高金燕.产学研战略联盟与企业原始创新能力[J].研究与发展管理,2015,27(6):29-39.
[10] STORY V M,DANIELS K,ZOLKIEWSKI J,et al.The barriers and consequences of radical innovations:introduction to the issue[J].Industrial Marketing Management,2014,43(8):1271-1277.
[11] SARKAR S,OSIYEVSKYY O,CLEGG S R.Incumbent capability enhancement in response to radical innovations[J].European Management Journal,2018,36(3):353-365.
[12] THOMPSON J D.Organizations in action:social science bases of administrative theory [M].New York:Transaction Publishers,1967.
[13] 柳卸林,何郁冰.基础研究是中国产业核心技术创新的源泉[J].中国软科学,2011,26(4):104-117.
[14] KUZMINOV I, BAKHTIN P,KHABIROVA E, et al.Mapping the radical innovations in food industry: a text mining study[EB/OL].2018-03-01.https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3143721&download=yes.
[15] BERS J A,DISMUKES J P,MEHSERLE D,et al.Extending the stage-gate model to radical innovation——the accelerated radical innovation model[J].Journal of the Knowledge Economy,2014,5(4):706-734.
[16] BESSEN J,MEURER M J.Patent failure-how judges,bureaucrats,and lawyers put innovators at risk [M].New Jersey:Princeton University Press,2008.
[17] HU Y,SCHERNGELL T,QIU L,et al.R&D internationalisation patterns in the global pharmaceutical industry:evidence from a network analytic perspective[J].Technology Analysis & Strategic Management,2015,27(5):532-549.
[18] CILIBERTI S,CARRARESI L,BRÖRING S.Drivers of innovation in Italy:food versus pharmaceutical industry[J].British Food Journal,2016,118(6):1292-1316.
[19] KELCHTERMANS S,LETEN B,BELDERBOS R.The impact of internal & external basic research on the technological performance of pharmaceutical firms[C].Open Access Publications from Katholieke Universiteit Leuven,2010(2):25.
[20] BERCHICCI L.Towards an open R&D system:internal R&D investment,external knowledge acquisition and innovative performance[J].Research Policy,2013,42(1):117-127.
[21] GENG D,SAGGI K.The nature of innovative activity and the protection of intellectual property in Asia[J].Asian Economic Policy Review,2015,10(1):71-91.
[22] 吕苏榆,刘晓焕.TPP成员国药品专利保护对中国医药产品出口的影响[J].中国科技论坛,2017,33(3):102-108.
[23] 郑平安,赵铃莉.基于SWOT模型的中小型制药企业专利战略制定研究[J].知识产权,2015,29(1):77-81.
[24] 董丽,袁泉,李秀娟.构建我国制药企业专利风险评估机制的研究[J].中国新药杂志,2015,24(9):977-982.
[25] BAILY M N.Research and development costs and returns:the US pharmaceutical industry[J].Journal of Political Economy,1972,80(1):70-85.
[26] SHIMURA H,MASUDA S,KIMURA H.Research and development productivity map:visualization of industry status[J].Journal of Clinical Pharmacy and Therapeutics,2014,39(2):175-180.
[27] MOWERY D C,NELSON R R,SAMPAT B N,et al.The growth of patenting and licensing by US universities:an assessment of the effects of the Bayh-Dole Act of 1980[J].Research Policy,2001,30(1):99-119.
[28] HANSEN R W.The pharmaceutical development process:estimates of development costs and times and the effects of proposed regulatory changes[R].University of Rochester Medical Center,1979.
[29] DIMASI J A,GRABOWSKI H G.The cost of biopharmaceutical R&D:is biotech different[J].Managerial and decision Economics,2007,28(4/5):469-479.
[30] COMANOR W S,SCHERER F M.Mergers and innovation in the pharmaceutical industry[J].Journal of Health Economics,2013,32(1):106-113.
[31] NIRAD J, VIKRAM K, FRANZ R K, et al.Global healthcare corporate M&A report 2016[EP/OL].2018-03-16.https://www.bain.com/insights/global-healthcare-corporate-ma-report-2016/.
[32] GOH B K B,YEE A S V,KENDALL G,et al.Industrial R&D expenditure:its determinants and propensity of technology transfer of top ten companies in Malaysia,Singapore and Taiwan[J].Asian Journal of Innovation and Policy,2017,6(3):354-378.
[33] SMITH M.Pharmaceutical marketing in the 21st Century[M].Florida:CRC Press,2014.
[34] MOTOHASHI K.Catching up or lagging behind? assessment of technological capacity of China by patent database[J].China Economic Journal,2009,2(1):1-24.
[35] HOBDAY M.Firm-level innovation models:perspectives on research in developed and developing countries [J].Technology Analysis & Strategic Management,2005,17(2):21-146.
[36] WANG L S,PLUMP A,RINGEL M.Racing to define pharmaceutical R&D external innovation models[J].Drug Discovery Today,2015,20(3):361-370.