This paper puts forward "two dimensions of patent ethics", namely "institutional ethics" and "technical ethics". Institutional ethics of patent refers to whether the design of patent rules conforms to ethical norms, whether it is beneficial to the survival and development of human beings and whether it is fair;the technical ethics of patent is closely related to the invention, and it is a dimension closely related to the governance of scientific and technological ethics in patent ethics. Technical ethics also has two meanings: one is whether the process of invention conforms to ethical norms; the second is whether the technology or invention itself has potential ethical risks. In fact, whether technology itself violates ethics is not a simple legal issue, but an issue of value judgment. Therefore, the study focuses on the ethical issues in the R&D process of technology that applies for patent authorization, and the construction of relevant mechanisms for reviewing the ethical issues in the stage of patent application and authorization. Subsequently, combined with the current legislation and practice, it is pointed out that the lack of patent ethics review mechanism in China leads to some unavoidable practical problems. Then it demonstrates the necessity and significance of an ethical review of patent application. In the last part, it puts forward the method and path to construct the technology ethical review mechanism for patents in China.
It concludes that the lack of a special patent ethics review mechanism will not only lead to a poor connection between patent law and scientific and technological ethics norms within the framework of scientific and technological law, but it will also be difficult to regulate the ethical risks of independent research activities outside science institutes. Constructing a patent ethics review mechanism is helpful to realize the effective connection between science and technology law and patent law, enforce the compliance of scientific research procedures, and protect the interests of vulnerable groups. Therefore, firstly, the Patent Law should be revised to effectively link it with the science and technology law. Secondly, the principle of ethical review of patent application should be established; the ethical review of patent should not be at the expense of the efficiency of patent examination and approval; the ethical examination of patent should not excessively increase the burden of examiners and exceed their professional ability.Thirdly, a list of patent ethics review should be formulated. Classified and graded supervision procedures should also be implemented. Classified supervision means distinguishing between applications that need to accept ethical review and those that do not need to spend relevant resources to conduct review. Graded supervision is to distinguish between the strictness of ethics review and its applicable standards. It is necessary to set up "general procedures" and "summary procedures" for patent applications with technological ethical risks, and improve the self-discipline management of researchers and their awareness of ethical compliance.
《中华人民共和国科学技术进步法》自1993年颁布以来经历了3次修订。2007年修订加入了“禁止违反伦理道德的科学技术研究开发活动”的内容;2021年修订进一步完善了有关科技伦理监管的要求,新增了如下内容:“科学技术研究开发机构建立和完善科技伦理管理制度”、“科学技术人员在各类科学技术活动中遵守伦理规范”、“完善国际科技合作中的科技伦理审查机制”、“建立科技伦理委员会完善科技伦理制度规范,加强科技伦理教育和研究,健全审查、评估、监管体系”,“科学技术研究开发机构、高等学校、企业事业单位等建立健全科技伦理审查机制,开展科技伦理审查”,并明确了“违背科技伦理的法律责任”。2022年,中共中央办公厅、国务院办公厅印发的《关于加强科技伦理治理的意见》指出,随着我国科技创新快速发展,面临的科技伦理挑战不断增多,科技伦理治理仍存在机制不健全、制度不完善等问题。2023年12月,科技部等十部委印发的《科技伦理审查办法(试行)》正式生效,对企业、高校、科研机构等主体开展科技活动伦理审查提出了更高、更细致的要求。至此,科技法框架下的科技伦理治理体系基本确立。
构建完善的科技伦理审查体系,意在保障科技活动增进人类福祉,实现科学研究可持续发展。在20世纪40年代,科技活动中的“伦理倾销”现象就在全球范围内引起关注。尤其是在生物医学领域,该领域的研究在近现代呈现出“技术先行,伦理在后”的发展特征,导致伦理治理的法律体系与科学研究发展进步之间的距离进一步拉大[1]。1946年,纽伦堡审判后产生的《纽伦堡法典》成为国际层面最早的人体试验行为规范;1964年,《世界医学协会赫尔辛基宣言》诞生,进一步完善了以人作为试验对象的生物医学研究的伦理原则和限制条件。发达国家及地区也较早地开启了科技伦理治理,例如,1979年美国出台了《贝尔蒙报告》(Belmont Report)。随着数字技术的迅猛发展,美国近年来日益关注数字科技伦理治理,推出“人工智能战略与伦理监管政策”[2]。然而,虽然各国在科技法领域十分重视科技伦理治理规则的完善,却少有国家重视科技成果转化阶段的科技伦理审查问题。近年来,随着新兴技术的发展,专利授权审查的“实用主义”倾向愈发突出,导致专利授权审查缺乏伦理理性,甚至在一些情况下突破道德底线,严重威胁专利授权审查最为基本的安全与秩序的伦理价值要求[3]。在知识产权“强保护”的浪潮下,现代专利规则不断扩张,即可授予专利的主题(Subject)范围悄然扩大。这种扩张表现在两个方面——包容、宽松地解释可授予的主题的范围,狭义地限缩对专利主题的限制(Exclusion)[4]。例如,围绕生物技术领域的伦理争议长年不断[5],在授予涉及该领域的专利时本应将伦理要素纳入考量,谨慎地判断是否应当授予专利。然而,实践中道德条款已在欧盟被证明是“最有争议”的。欧洲专利局关于道德条款的指南及其先前关于伦理道德问题的决定和声明普遍反映出其不愿意涉及伦理问题,以及对道德/伦理在专利法中作用的狭隘解释。《欧盟专利条约》中的道德条款“只有在罕见和极端的情况下才可能被援引”,欧洲专利局在实践中对这些条款采取宽松和例外的应用[6]。再例如,澳大利亚在20世纪90年代关注到基因专利中的科技伦理审查问题,相关人士建议“由一个具有生物伦理专门知识的委员会审查涉及基因、遗传物质和转基因生物的专利申请”,然而该提议遭到议会的反对,认为这种方式将加大专利申请的不确定性并且导致专利审理复杂化。澳大利亚法律改革委员会(ALRC)2004年发布的《基因与独创性:基因专利与人类健康》(Genes and Ingenuity: Gene Patenting and Human Health)报告指出,“部分意见书建议在评估基因专利申请时考虑社会和伦理因素,并且批评ALRC不愿在专利制度框架内强调伦理和公共政策方面的考虑因素。还有一些意见书建议对专利法进行修订,将‘公共利益和社会影响标准’纳入专利申请的评审中”。也有国家对专利伦理审查问题持较为积极的态度。挪威国家科研伦理委员会指出,基于科研伦理的一般规范,例如科研的社会责任、自由和透明度,研究人员了解与专利伦理相关的问题至关重要。
综上可以认为,虽然当前普遍性国际知识产权条约、区域专利条约以及自由贸易协定(FTA)的知识产权章节均包含拒绝扰乱公共秩序、违背公共道德、对人类、动物或植物的生命或健康或对环境有害的发明创造的授权要求,较多国家早已关注到专利的技术伦理问题,但是,现有规则实际上只关注技术本身的伦理问题,却未重视专利技术研发过程中的伦理要求,也未在专利申请及授权阶段通过审核研发过程排除存在重大伦理缺陷的技术。与发达国家相比,我国科技伦理立法存在起步较晚、领域分散、内容抽象等问题[7]。随着我国科技法框架下的科技伦理治理体系不断完善,作为每年专利申请数量保持全球第一的专利大国,我国在走向专利强国的过程中也应进一步重视专利科技伦理审查相关问题。
专利伦理研究的是专利制度在运行实践中应当遵循的价值观念、伦理准则和道德规范[8]。专利制度本身包含专利规则建构与专利规则实施,专利规则实施又分成两个部分:授权前的专利申请与授权后的专利实施。也就是说,专利伦理可分为专利的制度伦理与专利的技术伦理两个维度。
专利的制度伦理,即专利规则的设计是否符合伦理规范、是否有益于人类生存与发展以及是否具有公平性。例如,现代国际知识产权条约中,无论知识产权的保护强度有多高,都未抛弃专利的强制许可规则、向最不发达国家转移技术的规则、与公共健康相关的知识产权规则,以及拒绝为违反法律、公共秩序或道德的发明授予专利权的规则。暂且不论这些规则是否能够真正被落实,能够明确的是,专利权人在对其技术享有垄断权的同时不能损害社会公共利益,发达国家主导的知识产权条约虽然致力于提升专利保护强度、延长专利保护期限、扩张专利客体范围,但是,不能不顾及发展中国家和最不发达国家居民的安危。在制度伦理的要求下,发达国家不能剥夺其它国家获取先进技术的权利。专利的制度伦理和其它部门法的法律伦理一样,是制定规则时立法者需要考量的必要因素,否则相关立法将存在损害社会公共利益甚至成为“恶法”的风险。
专利的技术伦理与专利法的客体,即专利法的保护对象——发明创造的技术伦理问题息息相关,是专利伦理中与科技伦理治理联系密切的维度。技术伦理也有两个层次的含义:一是技术形成过程是否符合伦理规范,二是技术本身是否具有潜在伦理风险。技术研发过程不符合伦理规范不一定必然导致技术本身不能获得专利授权,若改进研发过程,遵守相关科技伦理规范,最终的科技成果就不会因伦理问题而无法得到授权;在技术本身存在伦理问题时,例如发展极快的生物技术、人工智能技术引发较多的可专利性争议,伦理问题则可能直接成为不授予专利权的理由之一。两方面的专利技术伦理问题应基于其所处的科技活动阶段,受到不同部门法的规制。
当前技术研发过程的伦理问题主要受到科技法中科技伦理规范的约束(见表1)。《科技伦理审查办法(试行)》第52条指出,科技伦理风险是指科学研究、技术开发等科技活动中的伦理风险。第2条明确了科技伦理审查的对象是“涉及以人为研究参与者的科技活动以及利用人类生物样本、个人信息数据的科技活动”、“涉及实验动物的科技活动”、“可能在生命健康、生态环境、公共秩序、可持续发展等方面带来伦理风险挑战的科技活动”以及“依据法律、行政法规和国家有关规定需进行科技伦理审查的其他科技活动”。《关于加强科技伦理治理的意见》也指出,要将科技伦理要求贯穿科学研究、技术开发等科技活动全过程。科技法框架下的伦理监管更加偏重于对技术研发过程的监管。例如,《科学技术进步法》《科技伦理审查办法(试行)》提出的科技伦理审查的重点内容除简单地指出“对科技活动本身的价值及其风险的评估”外,用更多篇幅阐述对“科技人员资质、研究基础及设施条件”、“研究参与者的招募、利益保护与补偿”、“实验动物的来源及操作标准”、“数据收集、储存加工的规范性与算法设计的可控性”、“利益冲突申明和管理方案”的审查作出规定。尤其是涉及人的生命科学和医学研究的伦理监管,2003年我国出台《人胚胎干细胞研究伦理指导原则》,其中第5条、第6条规定了在我国境内从事涉及人胚胎干细胞的研究活动必须遵循的原则,对用于研究的胚胎干细胞的获得方式、研究方法进行了明确限制。至今,我国已在生命医学研究方面建立了主要由部门规章、国家强制性标准构成的伦理规范体系。除科技法框架下的技术伦理规则,我国其它部门法及行政法规中也包含针对具体问题的伦理规范(见表2),主要集中于药品研发、医疗器械研发领域。
表1 科技法中的技术研发伦理专门规范
Table 1 Specific provisions of technology ethics of R&D in science and technology laws
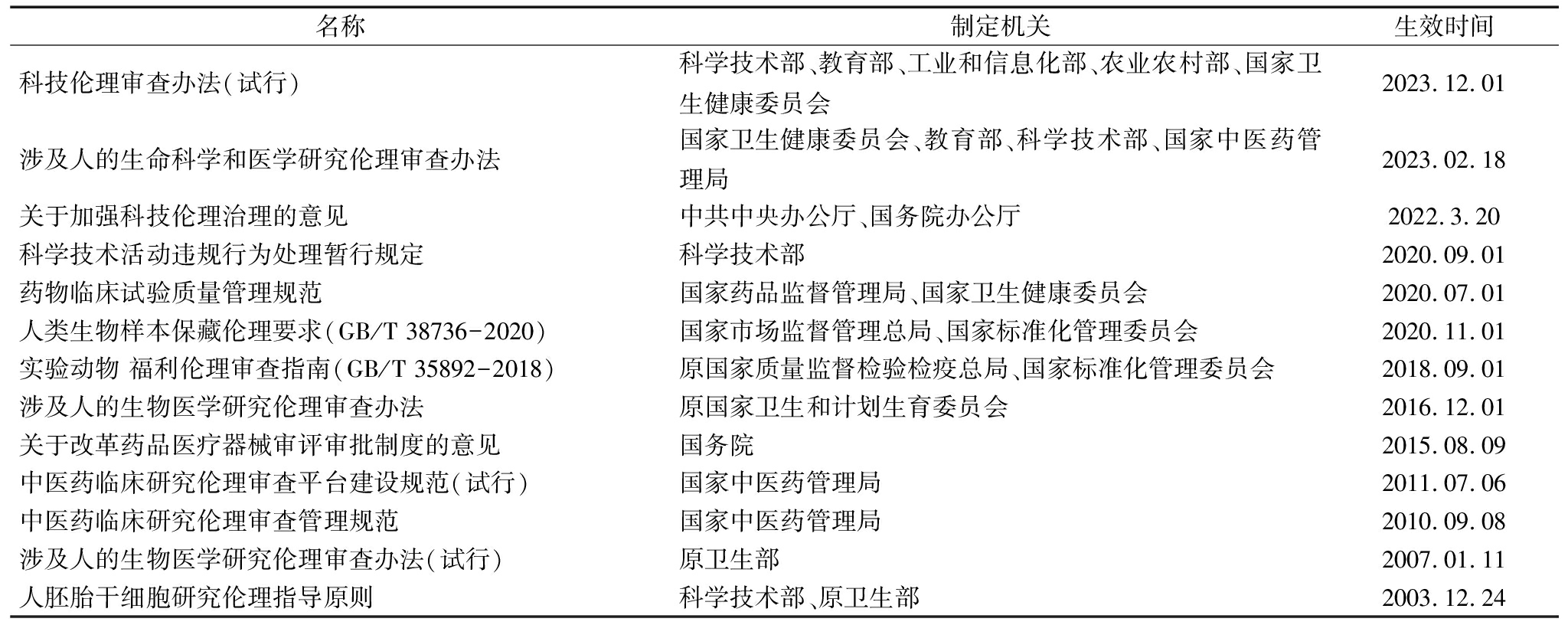
名称制定机关生效时间科技伦理审查办法(试行)科学技术部、教育部、工业和信息化部、农业农村部、国家卫生健康委员会2023.12.01涉及人的生命科学和医学研究伦理审查办法国家卫生健康委员会、教育部、科学技术部、国家中医药管理局2023.02.18关于加强科技伦理治理的意见中共中央办公厅、国务院办公厅2022.3.20科学技术活动违规行为处理暂行规定科学技术部2020.09.01 药物临床试验质量管理规范国家药品监督管理局、国家卫生健康委员会2020.07.01人类生物样本保藏伦理要求(GB/T 38736-2020)国家市场监督管理总局、国家标准化管理委员会2020.11.01实验动物 福利伦理审查指南(GB/T 35892-2018)原国家质量监督检验检疫总局、国家标准化管理委员会2018.09.01涉及人的生物医学研究伦理审查办法原国家卫生和计划生育委员会2016.12.01 关于改革药品医疗器械审评审批制度的意见国务院2015.08.09中医药临床研究伦理审查平台建设规范(试行)国家中医药管理局2011.07.06中医药临床研究伦理审查管理规范国家中医药管理局2010.09.08涉及人的生物医学研究伦理审查办法(试行)原卫生部2007.01.11 人胚胎干细胞研究伦理指导原则科学技术部、原卫生部2003.12.24
表2 其它法律及行政法规中受到特别关注的技术伦理规范
Table 2 Specific provisions of technology ethics in other laws and regulations
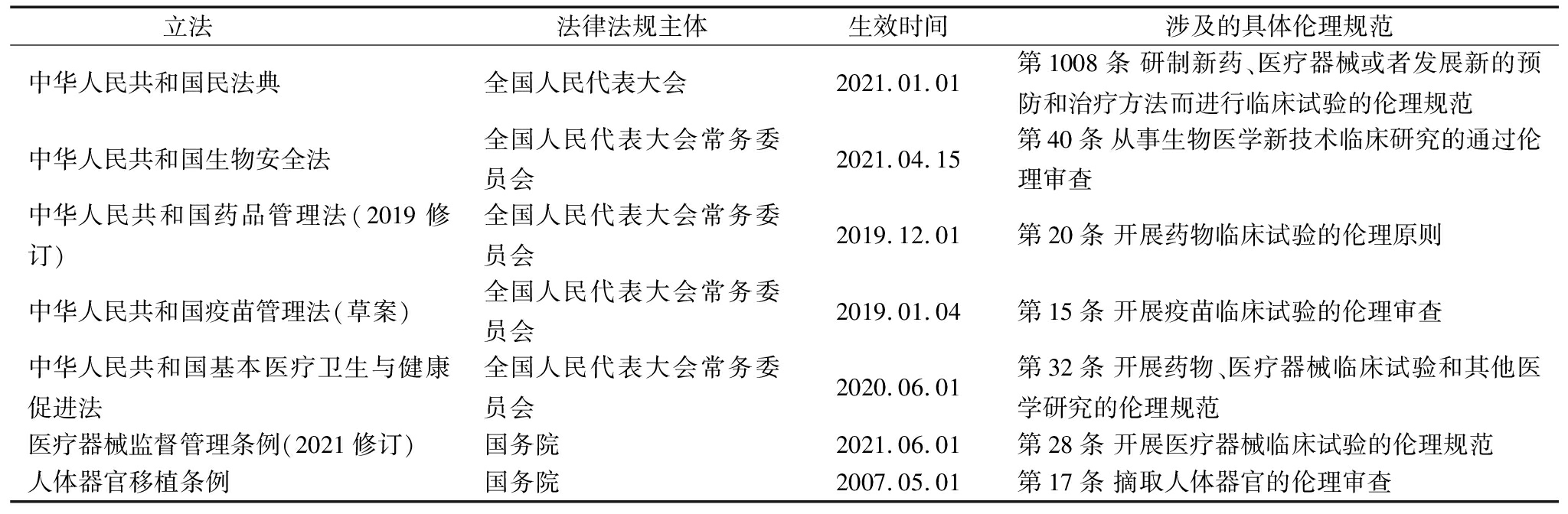
立法法律法规主体生效时间涉及的具体伦理规范中华人民共和国民法典全国人民代表大会2021.01.01第1008条 研制新药、医疗器械或者发展新的预防和治疗方法而进行临床试验的伦理规范中华人民共和国生物安全法全国人民代表大会常务委员会2021.04.15第40条 从事生物医学新技术临床研究的通过伦理审查中华人民共和国药品管理法(2019修订)全国人民代表大会常务委员会2019.12.01 第20条 开展药物临床试验的伦理原则中华人民共和国疫苗管理法(草案)全国人民代表大会常务委员会2019.01.04 第15条 开展疫苗临床试验的伦理审查中华人民共和国基本医疗卫生与健康促进法全国人民代表大会常务委员会2020.06.01第32条 开展药物、医疗器械临床试验和其他医学研究的伦理规范医疗器械监督管理条例(2021修订)国务院2021.06.01第28条 开展医疗器械临床试验的伦理规范人体器官移植条例国务院2007.05.01 第17条 摘取人体器官的伦理审查
技术是否会因其本身存在伦理风险而不被授予专利授权,主要受到《专利法》的约束。我国《专利法》第5条排除了违反法律、社会公德或妨害公共利益的发明创造的可专利性。此外,2020年修订《专利法》时还新增了“不得滥用专利权损害公共利益”的内容。除《专利法》的直接规制外,无论是《科学技术进步法》还是以《关于加强科技伦理治理的意见》为代表的部门规章,均在原则上强调对于技术本身的伦理审查,因此,科技法在很大程度上也能够成为阻止本身就不符合伦理的技术进入专利申请阶段的依据。
实际上,技术本身是否违背伦理这一问题并非单纯的法律问题,而是属于价值评判方面的问题,本文对此不作过多讨论,重点探讨专利技术研发过程中的伦理问题以及在专利申请及授权阶段对此进行审查的相关机制构建。
在专利申请及授权的过程中审查技术研究过程以及技术本身是否符合伦理是十分必要的。在科技伦理治理中,建立全过程的伦理审查机制至为关键[9]。从立法现状梳理可以看出,我国科技法构建了日益完善的科技伦理审查体系。我国科技法明确强调对科技活动“全过程”的伦理审查与监管,因此,科技伦理治理也应当包含科技成果转化为专利这一过程中的伦理审查及监管。作为授予申请人专利权之根本依据的《专利法》自然也应当成为规制专利科技伦理风险的主要法律依据,抑或是一道防线。然而,纵观我国《专利法》,专利科技伦理审查机制还处于缺失状态,进而导致科技法框架下的伦理审查规则在成果转化阶段很难被真正落实。
我国《专利法》第5条规定,原则上排除违反法律、社会道德、妨害公共利益的发明创造的可专利性以及违反法律和行政法规的规定获取或利用遗传资源完成的发明创造的可专利性,除此之外,无其它有关专利伦理的内容。2023年12月《专利法实施细则》被修订,最新的《专利审查指南(2023)》也同步问世,但是,有关专利伦理监管及审查的内容仍处于缺失状态。
(1)在“初步审查”部分,《专利审查指南(2023)》在《专利法》第5条的基础上加入了“明显”一词,即审查员参照指南的规定进行初步审查时,审查发明是否明显违反法律、社会道德,是否明显妨害公共秩序,一定程度上降低了技术的伦理标准。
(2)在“实质审查”部分,《专利审查指南(2023)》对“违反法律法规”“违背社会公德”“妨害公共利益”分别作出定义,但这些审查仅仅是对发明“成果”及其“影响”的审查,并非对“发明过程”的审查。此外,对于发明创造的相关审查仅依靠审查员自己的认知,并未进一步要求申请人提供相关证明材料。在“违反法律法规”的审查上,根据《专利法》中规定的申请流程以及《专利审查指南(2023)》“专利申请及事务处理”部分的相关要求,申请人提出发明专利申请所要提交的文件仅包含《专利法》第26条、第27条要求的请求书、说明书、权利要求书、说明书附图及其摘要,此外还应提供相关证明文件(其它文件),例如非职务发明证明、国籍证明、经常居所证明等。除“生物材料样品保藏证明”外,其它证明文件实际上与专利的伦理审查并无关联。如此一来,当违反了科研伦理的申请人只向审查员提供与其发明相关的材料,而未提供研发过程中其它部门法所要求的有关伦理审查的材料时,专利审查员在不了解其它部门法要求的情况下,并不会意识到该申请人可能已经违反其它部门法中有关科研伦理的强制性规定。在“违背社会公德”“妨害公共利益”方面,社会公德由“伦理道德观念”“行为准则”共同构成,《专利审查指南(2023)》还列举了包含“克隆的人或克隆人的方法”“人胚胎的工业或商业目的的应用”等在内的有违社会公德的发明不能被授予专利权的示例。与社会公德相并列的是“公共利益”,妨害公共利益即为“发明创造给公众或社会造成危害、使国家和社会的正常秩序受到影响”。可见,当前《专利审查指南(2023)》列举的可能存在科技伦理风险的情况主要集中在生命科学领域,至于人工智能等新技术存在的伦理争议问题,该指南并未涉及,更何况存在伦理不确定性的发明创造本身就是难以穷尽的,在审查员专业水平有限的情况下,判定新技术是否有违伦理确实较为困难。“专利伦理最小化”观点的支持者们亦将此作为反对在专利审查中加入伦理审查的理由。然而,审查存在困难并不应当作为不审查的理由。事实上,结合我国现有科技法框架下的科技伦理要求,大部分经过正规科研流程抵达专利申请阶段的发明创造是符合科学伦理的,在其它立法的监管下取得合规手续的科学试验的过程也符合伦理。其它立法的规制已经大大减轻了专利审查员的负担,之所以要加入该环节,是因为仍然存在一部分逃避前序监管的“漏网之鱼”。实际上,存在漏网之鱼的很大一部分原因在于科技法框架下的伦理治理规则与专利法之间出现脱节。
当前我国科技伦理治理体系由科技法及其它部门法共同构成,这就要求各项立法之间能够相互配合。从逻辑上讲,当科学研究以及技术本身已经违反现有科技伦理规则时,授予其专利权并不合乎常理,然而,由于当前专利法框架下的授权规则存在漏洞,科技法的监管也难以真正产生威慑性。
(1)《专利审查指南(2023)》对《专利法》第5条中所指出的“法律”作了解释,“违反法律”是指违反全国人大及其常委会所制定和颁布的法律。其不包括行政法规和规章,然而,除散见于《民法典》《生物安全法》《药品管理法》《疫苗管理法》等法律中的科技伦理规则外,在科技法框架下,仅《科学技术进步法》和《科技成果转化法》属于法律。但是,《科学技术进步法》中有关科技伦理的内容只是原则上的宣示性规定,散落在其它部门法中的科技伦理规则更是较为简略且模糊,反而是各种行政法规、规章甚至是规范性文件提供了更为细致、全面的科技伦理治理要求,在科技伦理治理中发挥基础性作用。例如,《科技伦理审查办法(试行)》《涉及人的生命科学和医学研究伦理审查办法》《关于加强科技伦理治理的意见》等,均属于部门规章。《药物临床试验质量管理规范》在药品研发过程中发挥重要的科技伦理监管作用,其同样属于规章。《科技伦理审查办法(试行)》所规定的“需要开展科技伦理审查的科技活动范围”中的兜底条款也采用了“法律、行政法规和国家有关规定”的表述,使得科技伦理审查的法律依据不局限于全国人大及其常委会制定的法律,进而促使科技伦理审查的覆盖面更广。
(2)从对“伦理”的表述上看,《专利法》第5条并未明确使用“伦理”这一表述,而是《专利审查指南(2023)》在对“社会公德”进行解释时使用了“伦理道德观念”,将伦理包含在社会公德内:“社会公德是指公众普遍认为是正当的、并被接受的伦理道德观念和行为准则”。由此,《专利法》第5条中的“社会公德”包含两个部分,即“伦理观念”与“行为准则”。根据《关于加强科技伦理治理的意见》序言部分,“科技伦理是开展科学研究、技术开发等科技活动需要遵循的价值理念和行为规范”。可见,从定性上看,科技伦理不仅是一种“价值观念”,也是“行为规范”。如此一来,科技法框架下的科技伦理实际上与《专利法》“社会公德”条款中的狭义上的“伦理”不同,进而不应被包含在“社会公德”中,而应与社会公德相并列(见图1)。
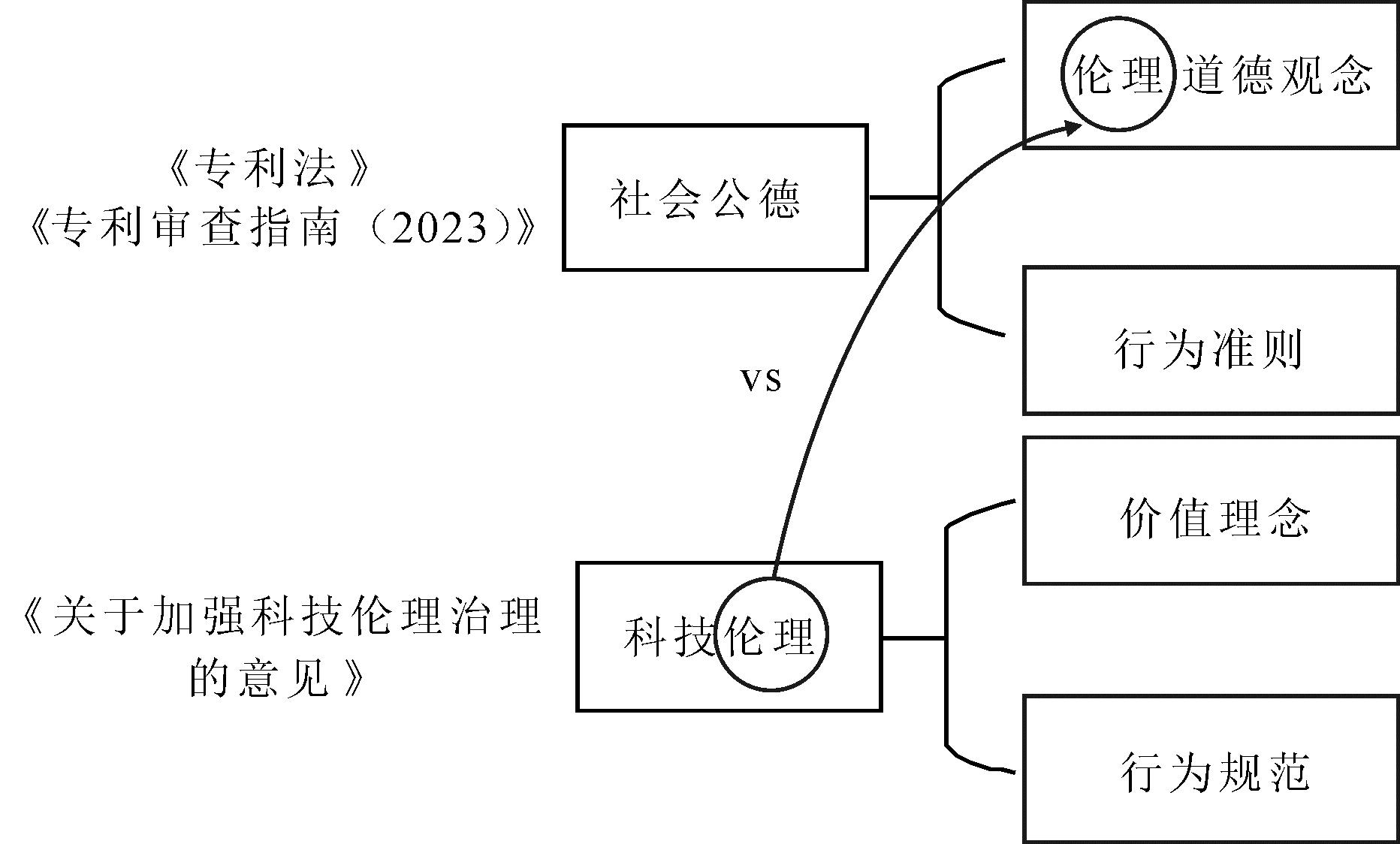
图1 《专利法》《专利审查指南(2023)》与《关于加强科技伦理治理的意见》中“伦理”定义的区别
Fig.1 Differences on the definition of "ethics" among Patent Law, Guidance of Patent Examination(2023) and Guidelines to Strengthen the Governance over Ethics of Science and Technology
此外,根据《科技伦理审查办法(试行)》第52条,科技伦理风险是指“从伦理视角识别的科学研究、技术开发等科技活动中的风险”,该条还明确了“最低风险”即“日常生活中遇到的常规风险或与健康体检相当的风险”。由于《专利法》目前并未注意到科技伦理问题,审查员在审查发明是否违反社会公德时依据的标准实际上即为科技法视域下只能算作最低风险的“日常生活中的常规道德风险”。由此可以发现立法之间的重大差异。
科技法和专利法之间规则上的冲突会导致申请人违反《科技伦理审查办法(试行)》等规定的发明创造到了专利申请环节有可能获得专利授权。《关于加强科技伦理治理的意见》所提出的“将科技伦理治理贯穿于科技活动的全过程”的要求无法在科技成果转化阶段得到落实。可见,现行专利法有关伦理治理的规则十分局限,并未与科技法形成从宏观到微观的良好衔接,不利于科技向善目标的实现。
根据《科技伦理审查办法(试行)》,科技伦理审查的责任主体主要是高等学校、科研机构、医疗卫生机构以及企业,审查的内容是研究人员在单位中开展的科技活动。在此背景下,研究人员在其单位监管外开展的独立研究活动以及未受聘于任何单位的独立研究者(Independent inventors)的科研活动难以受到约束。
即使当下高等院校、科研机构早已建立内部的科研伦理治理规章制度,但是,目前有不少科研人员对科技伦理原则和科研道德规范的理解还不够深入,尚未形成完全自觉的科技伦理意识和自律能力(鲁晓等,2023)。在医药学人体试验中,研究者的伦理意识不足、伦理委员会的审查流于形式、对受试者保障不力等问题仍然存在[10]。2018年“贺建奎基因编辑婴儿事件”是典型案例,贺建奎及其研究团队通过自筹资金的方式逃避其所在单位的监管,顺利地将其实验开展到最后一步。当然,彼时《科技伦理审查办法(试行)》尚未颁布,也正是在该事件之后,我国对科技伦理治理有了前所未有的关注。
未就职于任何机构的独立研究者违背科技伦理开展研究的风险可能更大。所谓“独立研究者”或“独立发明人”,即自筹研究经费的个人,或者受到企业等其它主体的资助但并未受雇于出资方的个人。独立研究者在科学技术发展中起到重要作用。以美国的相关研究为例,直到1930年,美国授予独立发明人的专利数量是R&D公司的三倍多,独立发明人的专利占到彼时美国专利的一半以上,为创意市场贡献了大量高质量创新成果[11]。在独立研究模式下,研究人员的自由度较高,尤其是在发明人有意逃避监管的情况下,其研究过程较少受到相关机构的监督;同时,提供资助的企业或其它机构也能够通过隐秘资助而逃避其应当履行的监管责任。因此,仅靠科技法规定的由单位的科技伦理委员会进行审查并不能百分之百地保障监管活动顺利开展。《科技伦理审查办法(试行)》提及“无单位人员开展科技活动的,应书面委托满足要求的研究机构实施伦理审查”,抛开了以往必须挂靠研究机构才能开展研究的限制(周维佳等,2024),但是,实践中这类人员能够轻易规避审查。到了申请专利阶段,审查员所审查的材料中并不包含科技法及其它规定要求单位(有资质的机构)出具的审核材料,如此一来,机构外的独立科研活动的伦理风险必然大大提升。
科技法以宏观性的法律方式对科技发展起到促进、鼓励、保障、引导和控制作用;专利法则关乎从事科技活动的主体的人身权及财产权等民事权利[12]。虽然各司其职,但是,科技法和专利法并非相互割裂,科技成果的确权、保护及技术流转和贸易是科技法与专利法的交叉重叠之处[13]。因此,科技法框架下的科技伦理治理并非到了科技成果转化阶段即告停。科技伦理治理应当体现在宏观上的科技活动监管与具体的专利权授权两个方面。如图2所示,科技创新流程可以分为科技成果研发和科技成果转化两个阶段。科技成果转化是科技法与专利法进行衔接的重要步骤。有学者指出,当前欧盟在专利审查实践中呈现出以最大程度减少乃至消除对于发明创造伦理审查为目标的“伦理最小化”的实用主义倾向,尤其是在本身就存在伦理规则不明确的新兴技术领域,由产业利益所主导的伦理最小化的专利审查实践可能导致“伦理迷失”的后果[14]。从逻辑上看,科技法要求科技活动全过程都受到科技伦理的规制,那么科技成果转化为专利这一阶段必然也需要遵守科技伦理审查规则及标准。若科技法构建起严格的、高标准的科技伦理审查体系,专利法却以“伦理最小化”的标准实现科技成果转化,则无疑会产生立法之间价值取向冲突的问题。
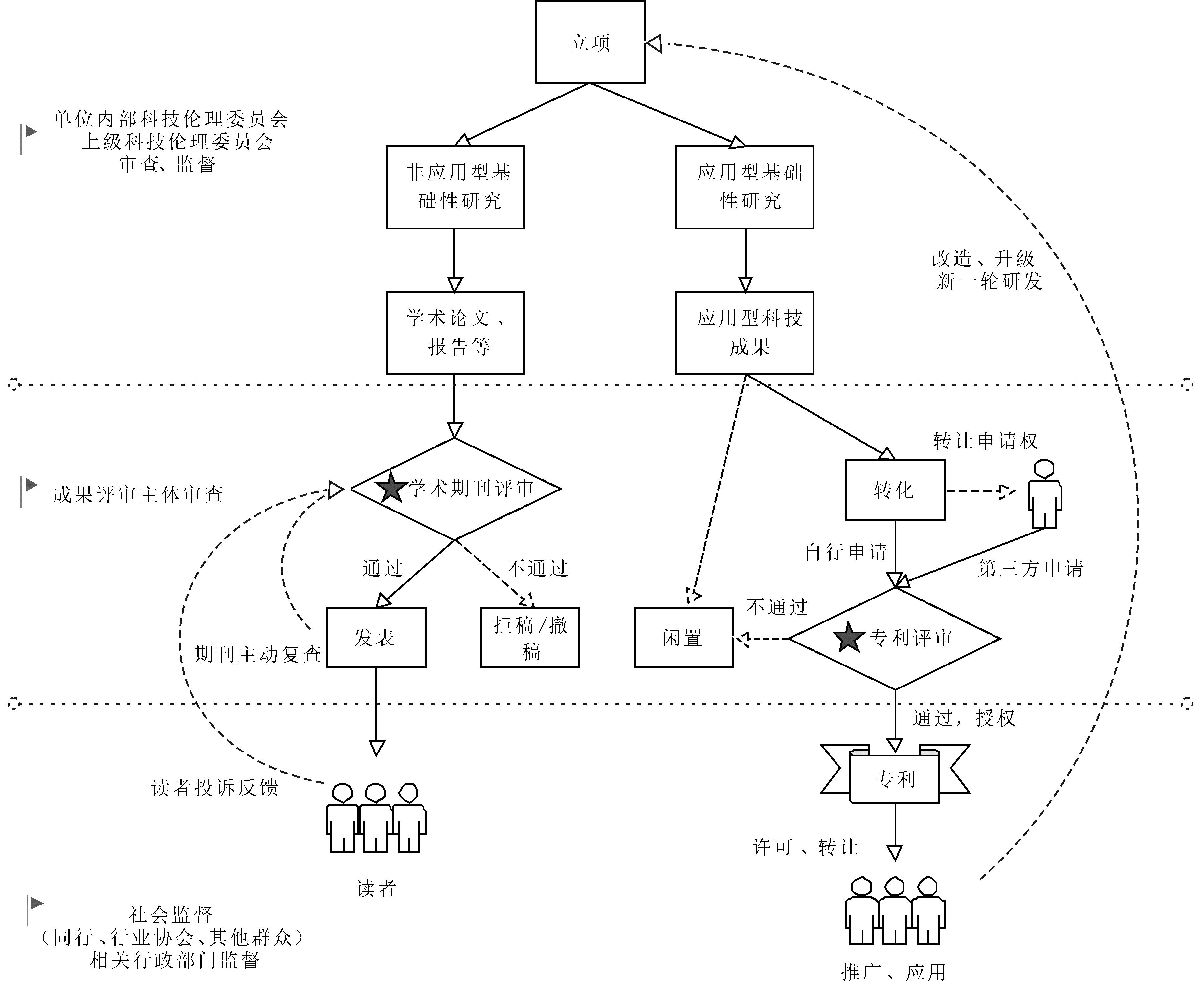
图2 不同类型科研活动及其成果转化的两种主要模式
Fig.2 Different types of scientific research activities and their two main modes of transformation of research achievements
专利申请环节的科技伦理审查能够验证研发阶段的科技伦理治理有效性,也是落实科技法框架下的科技伦理治理规则,倒逼研究者及其所在单位遵守科技伦理规范的重要方式。科研成果根据其特性,最终归宿要么是发表学术论文,要么是申请专利保护。当然,也有一部分科研成果会作为商业秘密予以保护,还有一部分成果因为转化失败而被闲置。科技期刊是维护科技伦理的重要防线[15]。期刊对于学术论文的审核以及发表之后同行对于该成果学术规范方面的监督,在很大程度上能够激励研究者遵守学术规范以及科研伦理。随着《关于加强科技伦理治理的意见》的发布,我国已经有期刊开始注意对其所发表科研成果的科技伦理审查。例如,有医学领域的学术期刊指出,医学期刊编辑应该了解相关伦理标准和规范,避免伦理问题的出现(廖常莉,2023);也有农业领域的学术期刊提出,农业科技期刊作为科技成果传播平台,只有建立完善的农业科技伦理审查制度才能有效防控农业科技伦理风险,引导农业科技向善发展(张梅等,2023)。
通常情况下,学术性更强的非应用型基础研究通常由高校或科研机构主导,成果基本上通过发表论文进行转化。应用型科学研究的发起者、主导者及其成果转化大多涉及企业,除企业自行进行研发外,企业还会通过横向课题等产学研一体化的方式与高校、科研院所开展合作,这也是我国近年来提升高校等科研主体科技成果转化率的重要方式。根据《促进科技成果转化法》,高校科研成果的转化方式主要有两种,一是高校自行转化实施,二是专利权交易,包括高校自主申请专利然后许可、转让给企业实施,或者直接转让专利申请权给企业,并由企业申请和实施专利。鼓励校企间知识分享和资源互补也是提升高校科技成果转化价值的重要手段之一[16],相关研究表明,高校及科研院所倾向于与企业合作开发发明专利,这两大主体对长三角生物医药产业一体化具有一定推动作用[17]。产学研一体化进程中的各项试验是否合规值得关注,即使是高校主导研究过程,从研究选题、立项到成果转化,企业在其中所起的作用也不容小觑——企业是“伦理最小化”的专利审查标准的主要推动者,虽然科技法以及各部门法均为企业科研活动施加了伦理限制,要求其承担社会责任,但是,在利益的驱动下,很难保证所有企业在自行研发时对技术本身的伦理问题进行严格审查以及在技术研发过程中恪守伦理规则,也很难保证高校不会为有违伦理规范的研究立项,以及保证在研究过程中不会出现违反相关伦理规则的现象。
综上,构建专利科技伦理审查机制,一是能够对研究者形成威慑,倒逼其在研究立项、科学试验的过程中考量伦理问题;二是能够避免资源浪费,当专利的科技伦理审查成为研究者及资助者需要跨越的一道障碍时,他们就会更为谨慎。
通过专利伦理审查过滤研发过程有违科技伦理以及本身就存在伦理争议的发明创造,能够最大程度保护参与研发的受试群体的利益。相较于掌握更多专业知识、拥有更多信息且充分知晓试验风险的研发人员及资助者,受试对象通常是对相关研究缺乏认知的普通人。人体试验技术伴随风险的不确定性(李憣等,2020),无论是发达国家还是发展中国家,以人或人体器官为试验对象时,大部分国家都有较为严格的规定,以防范企业为获取利益而不顾受试对象的安全,同时,也能够防止人口、器官贩卖问题。为保证药物临床试验过程规范,数据和结果科学、真实、可靠,保护受试者的权益和安全,2003年我国颁布《药物临床试验质量管理规范》,并且根据实践需要,于2020年进行了修订,该规章专门指出“伦理审查与知情同意是保障受试者权益的重要措施”;2007年颁布《涉及人的生物医学研究伦理审查办法(试行)》,2016年《涉及人的生物医学研究伦理审查办法》正式文本生效;2015年颁布的《国务院关于改革药品医疗器械审评审批制度的意见》也指出,允许境外未上市新药在我国进行临床试验,鼓励国内临床试验机构参与国际多中心试验,但是,会重点审查受试者保护的相关内容,同时强化创新药申请人、临床试验机构以及伦理委员会对受试者的保护责任。2023年国家卫生健康委等部门颁布《涉及人的生命科学和医学研究伦理审查办法》,进一步强化与人体试验相关的伦理规范。纵观我国现有立法可以发现,其重点内容有二:一是通过日渐细化的规则保障受试者的知情同意权。受试者的知情同意是人体试验的核心内容之一,在上文提及的“基因编辑婴儿”事件中,受试者的知情权就没有得到保障[18]。二是强化伦理委员会的作用。之所以对伦理委员会提出更多要求,是因为即使受试者“知情且同意”,试验中也可能出现超出受试者认知的风险,这类风险只能由具有专业知识的伦理委员会进行评判,进而最大程度保障受试者的安全。有研究指出,相当一部分从事生命科学、医学、人工智能等科技活动、有伦理审查需求的各类创新主体没有设立科技伦理(审查)委员会,已设立的科技伦理委员会在运行时仍存在较多不完善之处,存在伦理审查流于形式的现象(宋应登等,2024)。当研究者规避伦理委员会的监管,或相关企业、研究机构放松监管,设立的伦理委员会审查不严,放任有较大伦理瑕疵的科学试验顺利开展并最终获取成果时,专利授权阶段的伦理审查要求就成为维护试验伦理以及保障受试者权益的最后手段。
从国际层面上看,对于发展程度较低、立法不完善的国家的居民来说,发达国家企业在其境内开展人体试验时能否符合伦理、保障受试者的安全则很难评估。尤其是在药物研发过程中必须开展的人体试验方面,为了规避本国较为严格的法律,使得试验能够开展,同时降低成本,跨国(尤其是到发展程度较低的发展中国家和最不发达国家)进行人体试验已经成为发达国家制药企业的常用手段。当发达国家在发展中国家及最不发达国家开展扰乱东道国公共秩序、违背公共道德、对东道国受试居民的健康、动物或植物生命健康或对环境带来重大损害的试验时,东道国居民作为弱势群体,其权益大大受损。即使不能在东道国获得专利授权,由于专利的地域性,隐瞒对东道国的伤害并到东道国之外的其它国家申请专利则极有可能不存在任何阻碍。由此可以发现,阻止有较高伦理风险的跨国试验(尤其是人体试验),除有利于保障受试者的人权外,还有助于维护一国的生物安全,进而避免国家安全受到威胁。
结合科技法框架下的科技伦理治理规则以及《民法典》等立法中有关具体领域科学活动的伦理审查要求,审查员开展专利科技伦理审查可以分成两个部分:一是对技术本身是否符合伦理进行审查,重点在于该技术所带来的影响;二是发明创造过程的伦理合规问题。若技术本身就不符合伦理,那么无需再进行第二步;若技术本身不存在伦理问题,那么应重点关注其研发过程,避免因技术本身属于常规的合乎伦理的技术而忽略研发过程中存在的伦理风险;若研发过程也合规,那么可进入实质审查环节。对此,《专利法》及其实施细则和《专利审查指南》可作相应修改。
(1)对《专利法》第5条的表述进行修改。第一种方式为,参照《科技伦理审查办法(试行)》的表述,将第5条第1款“违反法律”修改为“法律、行政法规和国家有关规定”,进而将诸如《科技伦理审查办法(试行)》《药物临床试验质量管理规范》等与科技伦理治理相关的部门规章及行政法规、规范性文件纳入到审查的范围内,使得那些本身没有伦理上的不确定性但研发过程违反相关规则产生伦理瑕疵的发明受到规制。然而,《专利法》第5条作为原则性、普遍性规定,为了纳入科技伦理审查而扩张第5条第1款中“法律”的界限所产生的影响可能较大。因此,可以采用第二种方式:在第5条第2款后新增第3款“对不符合科技伦理规则的发明创造,拒绝授予专利权”。同时,在《专利审查指南》的“发明专利申请初步审查”章节的第7.2条“根据专利法第五条的审查”中新增“科技伦理审查”,加入对科技伦理的解释,具体内容应参照科技法中对科技伦理的治理以及审查要求,进而间接地将科技法框架下有关科技伦理治理的行政法规、规章纳入到审查范围内。
(2)在《专利法》第26条中新增一款“科技伦理审查证明文件”,即“申请发明专利的,应当提交科技伦理审查证明文件”。具体而言,证明文件的范围包含《科技伦理审查办法(试行)》中所要求的开展科技活动的伦理审查材料,例如该办法第9条所要求提供的各种审核材料、第16条规定的科技伦理(审查)委员会的“批准决定”,以及其它法律法规中所要求的开展科技活动的伦理审批材料,例如《民法典》第1008条、《涉及人的生命科学和医学研究伦理审查办法》第18条要求的研究材料诚信承诺书、知情同意书、生物样本、信息数据来源证明等。同时,以上内容可在《专利审查指南》中“科技伦理审查”部分加以规定。
专利科技伦理审查不应以牺牲专利审批效率为代价。当前我国已经签订的大部分多边FTA的知识产权规则都含有“保障专利审批的效率”的内容。例如,已对我国生效的《区域全面经济伙伴关系协定》(RCEP)以及我国已正式申请加入的《全面与进步跨太平洋伙伴关系协定》(CPTPP)均要求,缔约国行政部门在专利申请人提交专利申请的申请日或优先权日起的第18个月届满后迅速公布专利申请结果。还进一步鼓励缔约方规定专利申请人可要求依照该缔约方的法律、法规和规章加速对其专利申请进行审查的国内程序(马忠法等,2022)。CPTPP还规定了“专利补偿期”制度,即调整因行政授权流程而实质上被“缩短”了的专利期(马忠法等,2021)。尤其是对于药品,除尽最大努力保障审批效率外,还可以采用调整专利期的方式或者以“额外专门保护期限”(即补偿期)的方式进行处理[19]。此外,《中美经贸协议》中相关规则更为严格。由此可见,提升专利审查效率防止不合理的延迟已成为我国必须履行的条约义务。目前我国发明专利审查平均周期缩短至16个月,按照国际审查周期可比口径统计,从申请至授权,我国审查周期短于美、欧、日、韩,位居世界前列。因此,专利的科技伦理审查程序的加入应当以不降低专利审查效率为重要原则。
专利科技伦理审查亦不可过度加重审查员的负担,超越其专业能力。根据《关于加强科技伦理治理的意见》,伦理审查委员会的组成人员应当具备专门知识。对于专利审查员而言,评估新技术本身以及研发过程是否符合科技伦理可能超出其能力范围,为其工作带来较大压力,进而降低审查效率,导致专利申请的审查时间被延长。因此,专利伦理审查标准的制定应当以不超出审查员能力范围为合理限度。此外,现行制度中专利审查员还承担着较重的证明责任,信息不对称的存在进一步增加了审查难度,也降低审查质效,使一些问题专利因信息误导等原因获得不当授权(黄国群等,2023)。因此,可以将证明责任分配给专利申请人,由其承担证明其发明过程符合科技伦理的责任。
为最大程度地降低专利科技伦理审查对专利审理效率的影响以及审查员的负担,可通过分类监管以及分级监管的方式设置专利科技伦理审查流程(见图3)。
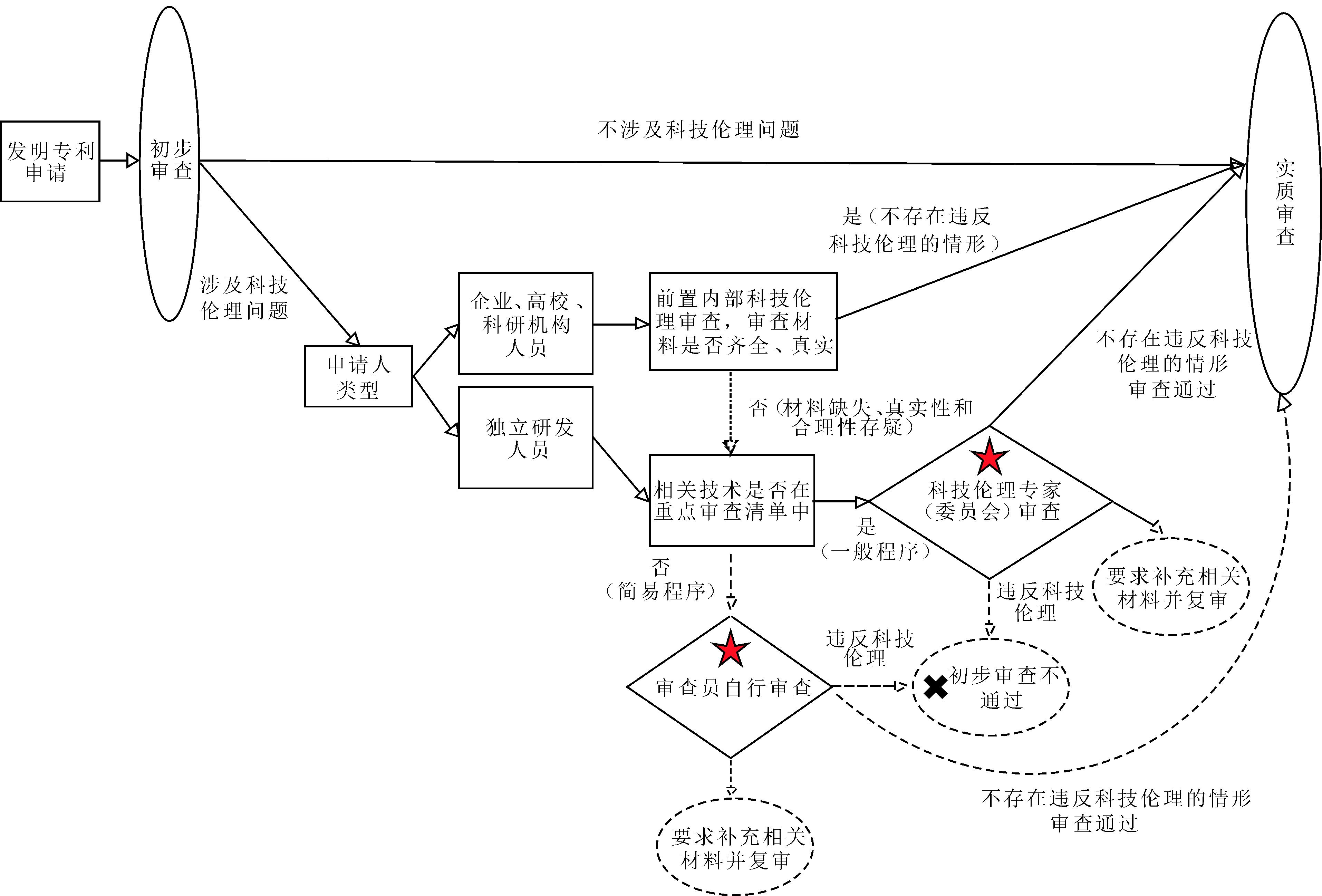
图3 专利科技伦理审查流程
Fig.3 Review process of ethics in science and technology for patents
4.3.1 分类监管
分类监管即区分需要进行伦理审查的申请以及无需再耗费相关资源开展审查的申请。
(1)根据专利种类,对发明专利进行科技伦理审查,对实用新型和外观设计专利则仅需按照目前的初步审查规则审理即可。此外,并非所有发明创造及其研发过程都伴随巨大的伦理风险。当审查员依据专业知识以及常识判定相关申请涉及的科技伦理风险极低甚至不存在伦理风险时,即可进入正常的普通审理流程。《专利审查指南(2023)》的初步审查部分已经对“涉及生物材料的申请”以及“涉及遗传资源的申请”作了特别规定,在材料核实的程序方面有更为详细的要求。从该指南的修订情况来看,随着新技术的出现,该指南在专利的实质审查部分也专门规定了对计算机领域、化学领域以及中药领域发明的特殊监管内容,并且近年来随着技术发展而持续动态更新特殊审查的范围及规则。例如,为回应创新主体对进一步明确涉及人工智能等新业态新领域专利申请审查规则的需求,2019年的修订新增了对“包含算法特征或商业规则和方法特征的发明专利申请审查”的特殊规定,涉及人工智能、“互联网+”、大数据以及区块链等的发明专利申请,在审查基准、审查示例、说明书及权利要求书的撰写3个方面与其它普通专利申请作了区分。2023年最新修订新增了“关于中药领域发明专利申请审查的若干规定”。可见,分类审查的模式具有可行性,可在修订《专利法》及《专利审查指南》的基础上,对可能具有科技伦理风险的专利申请的审查作特殊规定。
(2)根据专利申请人类型,分为依托相关单位开展发明创造的申请人以及独立开展研究的申请人。对于前者,要求其提供研究项目立项到结项过程中经由本单位科技伦理委员会出具的伦理审查通过的证明材料。当申请人提交的前置伦理审查材料完整、真实时,无需再重复审查。若存在前置材料不完整及真实性、合理性明显存疑等情况,则在专利申请阶段由审查员再度核查科技伦理情况。对于独立申请人,审查员根据法律、行政法规、规章等要求申请人提供相关材料,证明其发明本身及研发过程符合科技伦理规范。这样的模式能够最大程度避免重复审查,降低申请人和审查员双方的负担,保障专利审理效率。
4.3.2 分级监管
分级监管即区分专利科技伦理审查的严格程度及其适用的标准。对于存在科技伦理风险的专利申请,设置“一般程序”和“简易程序”。区分专利申请落入哪一种程序范围内的依据是“相关技术是否在重点审查清单中”。“清单”的内容则可参考《科技伦理审查办法(试行)》“附件”部分所制定的“需要开展伦理审查复核的科技活动清单”,其中包含对人类生命健康、价值理念、生态环境等具有重大影响的新物种合成研究、将人干细胞导入动物胚胎或胎儿并进一步在动物子宫中孕育成个体的相关研究、改变人类生殖细胞、受精卵和着床前胚胎细胞核遗传物质或遗传规律的基础研究等。此外,“清单”的内容不能与《专利法》的可专利性规则相冲突,还应结合实践情况进行动态调整。
对于进入科技伦理审查阶段的申请,若相关技术不在需要重点关注的领域内,则采用“简易程序”,即由审查员自行依据科技伦理治理相关法律法规等进行审查。例如,根据《科技伦理审查办法(试行)》第15条的“科技伦理审查内容及标准”,审查员可审查“参与科技活动的科技人员资质、研究基础及设施条件”、“科技活动是否具有科学价值和社会价值、是否增进人类福祉、实现可持续发展目标”等。审查员还可根据发明涉及领域已有的伦理审查标准进行审查。目前我国较多领域已形成专门的伦理审查标准,例如,《涉及人的生命科学和医学研究伦理审查办法》第19条规定审查的内容包含“研究者的资格、经验、技术能力”、“知情同意书提供的有关信息是否充分、完整、易懂”、“研究参与者招募方式、途径、纳入和排除标准是否恰当、公平”等。由此,整理、汇编现有科技伦理审查规则是构建专利科技伦理审查程序的重要工作内容。
若相关技术落入“清单”的范围内,则对其开展“一般程序”的审查。“一般程序”需要依托“科技伦理委员会”,即构建专家咨询机制。专家的参与能够克服审查员自身专业知识不足、独立审查较为困难且效率较低的问题,保障专利科技伦理审查的科学性以及专业性。此外,非利益相关者的加入也能进一步排除申请人所在机构的科技伦理委员会可能存在的违规、弄虚作假等问题。
科技伦理委员会的组建:第一,可以在国家专利行政部门设立专门的“科技伦理专家委员会”,专家可以来源于高校也可来源于业界实务部门。第二,可以依托申请人所在省份的科技治理行政部门已组建的“科技伦理委员会”进行专利科技伦理审查。近年来,随着科技伦理治理受到越来越多的关注,在各省科技治理行政主管部门的主导下,各省“科技伦理治理(专家)委员会”先后成立。例如,湖南省2022年发布《关于成立湖南省科技伦理治理委员会的通知》,指出“湖南省科技伦理治理委员会是全省科技伦理领域最高咨询、审查、规制、组织协调机构”,并于2023年初完成设立生物科学、医学、人工智能、实验动物4个领域专家委员会。国家专利行政部门可授权其在各省受理专利申请的代办处与各省科技伦理专家委员会进行合作。这种方式不仅能够克服设立专门的科技伦理审查委员会成本较高、审理专家压力较大的问题,还可以使得各省科技治理行政主管部门和知识产权行政主管部门之间的信息交流更为密切,帮助科技部门更加了解新技术发展趋势,也能使得各地科技伦理委员会的效用最大化。第三,应当加强新兴科技伦理委员会建设。从德国的经验看,已有大学设有较为前沿的“人—机—媒介”伦理委员会,以及因人工智能、新媒体、自动驾驶等的发展而设立的专业伦理委员会或综合伦理委员会[20]。
在伦理委员会与专利审查机构的互动方面,从其它国家的实践来看,《挪威专利法》要求挪威工业产权局在不确定一项发明的商业利用是否符合其专利法的伦理标准时与伦理委员会协商。21世纪初澳大利亚基因专利伦理问题报告中,有相关意见指出“将引起伦理评判的专利申请转交一个专门机构,该机构可以就这些问题提供指引或意见,或自行作出决定”。随后,新西兰、加拿大以及欧盟均出现过相似的立法建议。
从专利申请实务上看,申请人基本上都是委托专业的专利代理机构申请专利,因此,从行业自律的角度出发,要求代理机构加强对专利申请中科技伦理风险的把控也十分必要。专利代理机构对于申请人是否已完成前置科技伦理审查程序、是否需要在正式提交专利申请前进一步补充相关科技伦理证明文件的科学判断,能够在很大程度上减轻专利审查员以及科技伦理审查委员会的工作压力,进而保障专利审批效率。同时,有必要加强对专利代理机构的监管,防止其帮助申请人伪造相关证明材料。此外,应进一步提升申请人自身的科技伦理素养。企业、高校、科研机构应长期开展科研伦理教育,制定完善的科研规范以及考核标准,提升科研人员的科技伦理合规意识。
构建专利科技伦理审查机制的目的在于保障发明创造有利于增加人类福祉,实现“科技向善”的目标。无论是科技法还是知识产权法,都是人类科技文明源远流长的保障。现有的科技伦理监管规范只能在科学研究的启动和试验阶段发挥作用,在发明人将其研究成果转化为专利的阶段,科技伦理审查程序的缺失会导致逃避了前序监管的“漏网之鱼”成功转化为专利,并且通过专利许可、转让等方式使得存在伦理风险的技术向外传播。在专利初步审查阶段增加科技伦理审查的要求,有利于有效规避违背科技伦理的发明,促使发明创造真正有利于人类文明进步,避免带来无法挽回的人道灾难。
[1] 殷明雪,侯国跃.跨国人体试验伦理挑战及我国伦理审查制度因应[J].医学与哲学,2022,43(18):8-12,24.
[2] 肖红军,阳镇.数字科技伦理监管:美国进展与中国借鉴[J].财经问题研究,2023,45(6):73-86.
[3] 刘鑫.“科技向善”理念的专利法律回应——基于制度伦理研究路径的问题疏解[J].法律与伦理,2022,6(1):165-185.
[4] STERCKX S, COCKBAIN J. Exclusions from patentability: how far has the European patent office eroded boundaries[M].Cambridge:Cambridge University Press,2012.
[5] FORSBERG EM, HANSSEN AB, NIELSEN HM, et al. Patent ethics: the misalignment of views between the patent system and the wider society[J]. Science and Engineering Ethics,2018,24(5):1551-1576.
[6] MCMAHON A. Patents, governance and control: ethics and the patentability of novel beings and advanced biotechnologies in Europe[J]. Cambridge Quarterly of Healthcare Ethics, 2021,30(3):529-542.
[7] 李店标.我国科技伦理立法的理论逻辑与实践路径[J].学习与探索,2023,45(7):63-69.
[8] 刘鑫.论专利伦理[J].自然辩证法研究,2020,36(12):60-65.
[9] 杜盼盼,徐嘉.科技伦理治理中的全过程审查机制构建[J].云南大学学报(社会科学版),2024,23(1):47-55.
[10] 杨舒珺.论医药学人体试验中知情同意的伦理审查[J].中国医学伦理学,2020,33(12):1475-1479.
[11] NICHOLAS T. The role of independent invention in U.S. technological development, 1880—1930[J]. The Journal of Economic History, 2010,70(1):57-82.
[12] 杨丽娟,宋吉鑫.走出科技法与知识产权法相互割裂的误区——也论科技法与知识产权法之间的关系[J].知识产权,2011,25(7):60-63.
[13] 马忠法,黄玲玲.试论科技法与知识产权法之关系及其在高校教学体系中之设置[J].科技与法律,2008,20(6):3-7.
[14] 刘鑫.专利授权伦理审查的制度重构——从“科技向善”到“专利向善”的法律安排[J].法学评论,2023,41(3):89-100.
[15] 刘瑞,孙旻瑄,余茜,等.生命科学相关的科技伦理发展综述[J].编辑学报,2024,36(1):37-42.
[16] 朱相宇,陈林.我国新修订《促进科技成果转化法》实施效果评估——来自高校的证据[J].科技管理研究,2023,43(22):75-82.
[17] 万里,孙劲楠,丁佐奇,等.产学研合作模式下长三角生物医药产业一体化协同创新发展研究——基于专利合作及基金项目合作[J].中国药科大学学报,2022,53(6):742-752.
[18] 梅春英.从“基因编辑婴儿”事件反思人体试验中的知情同意[J].医学与社会,2020,33(7):124-129.
[19] 马忠法,王悦玥.RCEP与CPTPP鼓励性知识产权条款与中国因应[J].云南社会科学,2022,42(4):142-153.
[20] 王飞.德国科技伦理审查委员会的体系架构、工作机制及经验分析[J].中国科学基金,2023,37(3):403-409.